蛋白组学
99.6%
好评率
部分论文致谢
项目简介
一、项目介绍
蛋白质组学(Proteomics),是以蛋白质组为研究对象,研究细胞、组织或生物体蛋白质组成及其变化规律的科学。主要是利用高分辨蛋白质分离技术和高效的蛋白鉴定技术,在蛋白质水平上整体、动态以及定量地研究生命现象和规律,是系统生物学的有机组成分。目前科学指南针提供TMT、iTRAQ、Label free、靶向蛋白组学等多种蛋白质组学技术,这些技术广泛应用于蛋白质的定性和定量分析。
二、交付内容
检测报告(含测试流程,仪器型号等),交付时间4-6周,根据实验进展定,可能会变化。
结果反馈请在测试完成一周内反馈给指南针工作人员。
{{moduleItem.modulename}}
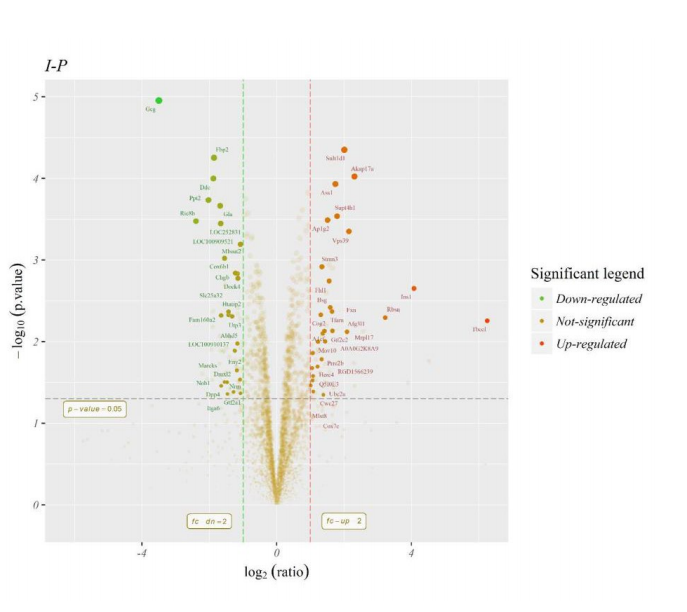
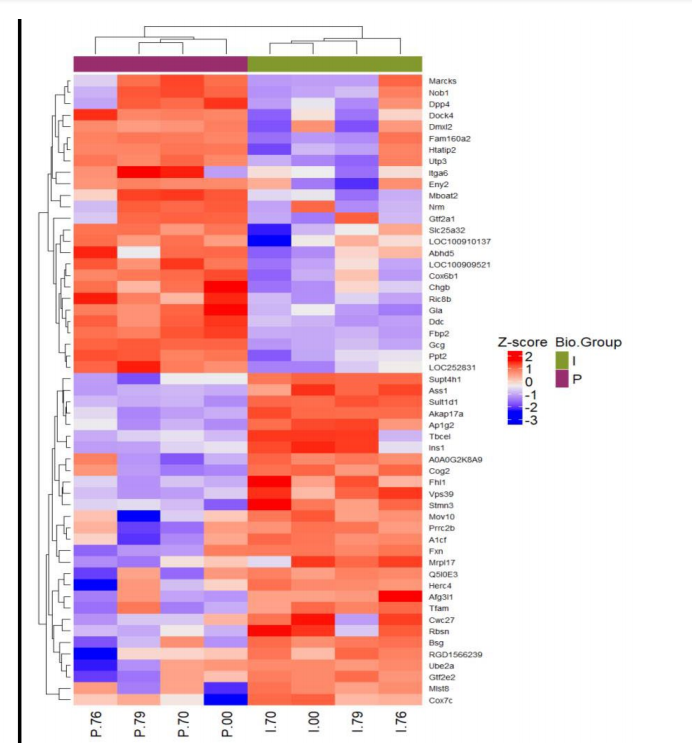
结果展示
样品要求
送样要求
|
|
样本类型 |
最低送样量 |
预处理及保存 |
|
胶点 |
2D 胶点 |
肉眼可见 |
用移液枪头将 2D 点挖下来,转入 EP 管中,做好标记,冰袋寄送 |
|
胶条 |
SDS-PAGE 条带 |
肉眼可见 |
将需要鉴定的 SDS-PAGE 条带切下,转入 EP 管中,做好标记,冰袋寄送 颜色非常浅的条带可取多个重复样本放一起 |
|
蛋白 |
冻干粉 |
50ug |
样品转入 EP 管中,做好标记,冰袋寄送 |
|
蛋白溶液 |
20ug以上的蛋白量(且蛋白浓度不低于0.1 μg/μL) |
样品转入EP管中,做好标记,冰袋或干冰寄送 Buffer要求:溶液中不能含有Triton100、NP40、CHAPS等去垢剂 |
|
|
|
培养基 |
15 mL以上 |
培养基样本不含血清或添加人工生物营养素; 根据细胞或菌体的蛋白分泌和细胞状态确认收集持续时长; 培养基样本需要经过过滤去掉细胞成分; 500 g离心5分钟去掉原培养基,使用无血清培养基清洗细胞三遍,用无血清培养基培养细胞24 h以上;500 g离心5分钟收集培养基;使用0.22 μm的滤膜过滤去除细胞或菌体;液氮速冻,-80 ℃保存,干冰寄送。 |
|
动物组织 |
常规动物组织(心、肝、脾、肺、肾、肠、脑、肌 肉等) |
100mg |
PBS 洗涤去除残留血液和污染物,迅速剥去脂肪和筋皮等结缔组织,冲洗干净,用组织剪或手术刀将组织分离成 1cm3 左右的小块,液氮速冻,保存于-80℃ |
|
软骨组织 |
100mg |
PBS 洗涤,用手术刀将软骨切成 1cm3 左右的小块,液氮速冻,保存于-80℃ |
|
|
软体动物(吸虫等) |
100mg |
PBS 洗涤去除来自宿主的污染,液氮速冻,保存于-80℃ |
|
|
植物组织 |
大本植物茎、叶、花等 |
200mg |
PBS 清洗,吸水纸吸去表面液体,液氮速冻,保存于-80℃ |
|
大本植物树根、树皮、树枝等 |
200mg |
PBS 清洗,吸水纸吸去表面液体,液氮速冻,保存于-80℃ |
|
|
种子 |
500mg |
PBS 清洗,吸水纸吸去表面液体,液氮速冻,保存于-80℃ |
|
|
果肉 |
2g |
去皮切成 1cm3 左右小块,液氮速冻,保存于-80℃ |
|
|
草本植物、藻类、蕨类等 |
200mg |
PBS 清洗,吸水纸吸去表面液体,液氮速冻,保存于-80℃ |
|
|
花粉 |
200mg |
植物开花期收集花粉,解剖显微镜下检查花粉,用解剖针去除花药碎片等杂质,转入 EP 管中,光学显微镜下检查花粉的形态和纯度,保存于-80℃ |
|
|
微生物 |
细菌类 |
200mg |
3000rpm-5000rpm 离心 5-15min,去上清,PBS 洗涤沉淀三次,液氮速冻,保存于-80℃ |
|
真菌类(菌菇) |
2g |
PBS 清洗,吸水纸吸去表面液体,液氮速冻,保存于-80℃ |
|
|
细胞 |
悬浮培养细胞 |
10^6 个 |
400rpm-1000rpm 离心 10 分钟收获细胞,弃上清,用预冷的 PBS 小心洗涤片状沉淀物 2 次,置于冰上, 去上清,液氮速冻,保存于-80℃ |
|
贴壁培养细胞 |
10^6 个 |
1.弃掉培养液,并将培养皿倒置于吸水纸上吸干培养液; 2.加入 4℃预冷的 PBS,平放轻轻摇动 1 分钟洗涤细胞,然后弃去 PBS,重复以上操作两次以洗去培养液 3.将培养皿置于冰上,向培养皿内加入 4℃预冷的 PBS,用干净的细胞刮棒将细胞刮于培养皿的一侧(动作要快),冰上斜置培养皿,使得缓冲液流向一侧,用移液管吸取溶解产物至预冷的离心管内,离心去上清。 4.液氮速冻,保存于-80℃。 |
|
|
体液 |
血清 |
100ul |
收集好的全血室温静置两小时,3000rpm 离心 10min,取上清,液氮速冻,保存于-80℃ |
|
血浆 |
100ul |
收集好的全血加入抗凝剂,室温静止 30 分钟,1300rpm-2000rpm 离心 10min,取上清,液氮速冻,保存于-80℃。 |
|
|
尿液 |
10ml |
5000rpm 4°C 离心 30-60min,取上清, 保存于-80℃。 |
|
|
唾液 |
1ml |
禁食两小时以上,上午取样,1000rpm-2000rpm 离心 5min,(或使用 0.22μm 滤膜过滤),取上清,保存于-80℃。 |
寄样要求
1. 样品管上名称和表中样品编号务必保持一致,除名称以外,请勿将其他信息标记于管盖,以避免出现可能的识别错误,后续分析报告按样品编号输出。
2. 锡纸包装的组织样品,将样品名称写在标签纸上并和样品一起装入塑封袋中,避免低温冰冻造成的样品名称无法识别。
3. 样品量要求具体和项目经理确认。
常见问题

1. TMT、LFQ和DIA三种技术有何区别,分别适用于哪些样本类型?
TMT、LFQ和DIA是目前最常用的三种基于质谱的高通量蛋白质组学定量方法。
TMT(Tandem Mass Tag,串联质量标签)方法的主要特征是在样品制备环节使用稳定同位素标记试剂与样品的酶解肽段进行反应,使待定量的肽段被标记上由多个基团组成的等质量标签,并在随后的检测中基于标签基团的信号进行多肽和蛋白的定量。
LFQ(Label Free Quantification,非标记定量)方法的主要特征是在样品制备环节无需稳定同位素标记,直接以肽段的检测信号进行肽段和蛋白的定量分析。
DIA(Data-independent Acquisition,数据非依赖性采集)方法的主要特征是其在采集质谱二级谱图时,并非基于一级谱图采集信号强度较高的肽段离子产生的二级谱图,而是根据所有离子质荷比范围划分窗口后依次采集所有肽段离子的二级谱图。
由此可见,三种方法是基于其在样品制备和谱图采集层面的主要特征来命名和划分的。
三种技术方法都可以进行高通量的蛋白质组学定量分析,理论上可以相互替代。但由于方法原理不同,这三种定量技术在实际应用中也存在不同的表现和偏向,因此针对不同的研究设计和样品类型,我们通常建议采用不同的定量方法,总结出如下面三种高通量蛋白质组技术的应用表现差异汇总表。












 您已经拒绝加入团体
您已经拒绝加入团体












