【摘要】 工业有毒化学品的排放对水资源的污染起着重要作用,但它并不是淡水资源流失的唯一原因。
工业有毒化学品的排放对水资源的污染起着重要作用,但它并不是淡水资源流失的唯一原因。水体中营养物质的存在是造成水质污染的主要原因之一。废水中离子营养物的出现,例如磷酸盐、硝酸盐或硫酸盐,可导致植物和浮游植物的异常生长。由于溶解在水中的氧含量随之降低(富营养化),这种异常发展以牺牲其他生命形式为代价[1]。获得安全饮用水和保护现有水资源与有效检测水污染物的可能性密切相关,通常是在微量水平,同时提供现场检测。几种分析技术用于检测水监测中感兴趣的化学物质,例如紫外分光光度法、色谱技术或电分析技术[2]。除了用于检测水系统中污染物的成熟技术外,近年来,微流体和光流体方法在水污染检测[3–5]以及免疫传感器等生物传感器[6]中也越来越重要。尽管最近的和整合的技术都有一些优点,例如它们的灵敏度和成本,但这些方法中的大多数都呈现出有害的特性,特别是在检测特定的水污染物时。此外,它们通常需要场外实验活动。因此,为了提供有效和及时的响应以保护公众健康,这些方法被认为过于耗时[7]。取而代之的是,可靠的微量化学物质现场检测应该与合理的成本和单一分析技术的使用相匹配。振动光谱提供了样品化学成分的丰富信息。然后,振动光谱(VS)提供了同时检测不同水污染物的可能性。因此,在过去的几十年中,VS因其在水质监测方面的潜力而引起了科学界的极大兴趣。除了广泛的化学和微生物污染物检测范围外,VS还需要最少的样品制备,而且是一种快速技术[8,9]。在VS技术中,拉曼光谱(RS)和红外光谱(IRS)由于其光谱的特异性而能够识别分子,因此经常被用作分析技术。在某种程度上,由于拉曼光谱和红外光谱的起源不同,RS可以被视为红外光谱的补充技术。特别是,如果在振动过程中分子的极化率发生变化,则振动为拉曼活性,而如果分子偶极矩发生变化,则振动为红外活性[10]。由于技术进步,在过去几年中,拉曼光谱的分析能力有了显著的提高[11,12]。今天,拉曼光谱是一种被认为足够成熟的分析技术,用于水分析,文献结果证明了这一点[7]。这尤其适用于实验室环境中的高性能仪器,但对于便携式拉曼系统来说就更少了。事实上,由于拉曼跃迁的低截面,RS具有低灵敏度,因此影响设备灵敏度,特别是在通常使用紧凑和低成本探测器的便携式传感器中。这一缺点因含有壁的溶液产生的荧光或拉曼信号产生的背景噪声而得到强调。拉曼光谱应用在检测硝酸废液的光谱图。
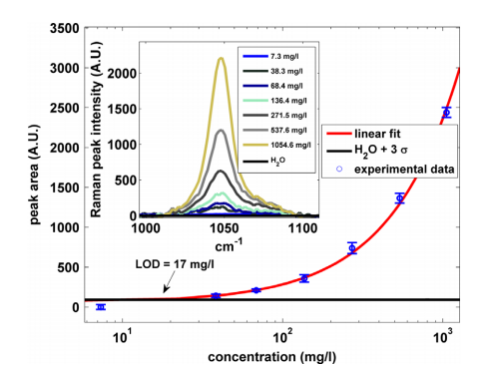
图一 NO3溶液的校准曲线。黑色水平线表示检测极限。插图中报告了不同浓度下的拉曼光谱。
参考文献
[1] J. Pelley, Is coastal eutrophication out of control? Environ. Sci. Technol. 32 (19) (1998) 462A–466A, http://dx.doi.org/10.1021/es983777p.
[2] R. Bhadekar, S. Pote, V. Tale, B. Nirichan, Developments in analytical methods for detection of pesticides in environmental samples, Am. J. Anal. Chem. 2 (8A) (2011) 1–15, http://dx.doi.org/10.4236/ajac.2011.228118.
[3] G. Testa, G. Persichetti, R. Bernini, Microfluidic optical methods: a review, in: A. Scozzari, E. Dotsika (Eds.), Threats to the Quality of Groundwater Resources: Prevention and Control, Hdb. Env. Chem. ©, Springer-Verlag, Berlin Heidelberg, 2014, pp. 257–278, http://dx.doi.org/10.1007/698_2013_253.
[4] S. Ishii, T. Nakamura, S. Ozawa, A. Kobayashi, D. Sano, S. Okabe, Water quality monitoring and risk assessment by simultaneous multipathogen quantification, Environ. Sci. Technol. 48 (9) (2014) 4744–4749.
[5] I.H. Chang, J.J. Tulock, J. Liu, W.S. Kim, D.M. Cannon Jr., Y. Lu, P.W. Bohn, J. V. Sweedler, D.M. Cropek, Miniaturized lead sensor based on lead-specific DNAzyme in a nanocapillary interconnected microfluidic device, Environ. Sci. Technol. 39 (2005) 3756–3761, http://dx.doi.org/10.1021/es040505f.
[6] F. Long, A. Zhu, H. Shi, Recent advances in optical biosensors for environmental monitoring and early warning, Sensors 13 (2013) 13928–13948, http://dx.doi. org/10.3390/s131013928. [7] Z. Li, M.J. Deen, S. Kumar, P.R. Selvaganapathy, Raman spectroscopy for in-line water quality monitoring-instrumentation and potential, Sensors 14 (2014) 17275–17303, http://dx.doi.org/10.3390/s140917275, doi:10.3390/s140917275.
[8] A. Gowen, R. Tsenkova, M. Bruen, C. O’donnell, Vibrational spectroscopy for analysis of water for human use and in aquatic ecosystems, Crit. Rev. Environ. Sci. Technol. 42 (2012) 2546–2573, http://dx.doi.org/10.1080/ 10643389.2011.592758.
[9] M. Harz, P. Rösch, J. Popp, Vibrational spectroscopy – a powerful tool for the rapid identification of microbial cells at the single-cell level, Cytometry A 75 (2009) 104–113, http://dx.doi.org/10.1002/cyto.a.20682.
[10] R.L. McCreery, Raman Spectroscopy for Chemical Analysis, John Wiley & Sons, Inc,, New York 2000 http://dx.doi.org/10.1002/0471721646.
[11] A. Kudelski, Analytical applications of Raman spectroscopy, Talanta 76 (2008) 1–8, http://dx.doi.org/10.1016/j.talanta.2008.02.042.
[12] D. Pappas, B.W. Smith, J.D. Winefordner, Raman spectroscopy in bioanalysis, Talanta 51 (2000) 131–144, http://dx.doi.org/10.1016/S0039–9140(99)00254– 4.
科学指南针为超过3000家高校和企业提供一站式科研服务。截止2021年6月:服务1049家高校、2388家企业,提供249所高校研究所免费上门取样服务,平均每天处理样品数5000+、 注册会员数18w+、平均4.5天出结果、客户满意度超过98%。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2022-03-17
2022-03-17
 4114
4114
 0
0










