【摘要】 为了更好地研究α-chym与胶束内水的相互作用,使用纳秒分辨率的稳态和瞬态测量证明了含水量和初始 pH 值变化(从 7 到 10)的微小差异,并允许讨论,结果为不同类别的 Trp 残基
蛋白质的荧光发射通常是不均匀的。这种异质性可能来自不同的荧光团,如酪氨酸、色氨酸(Trp)和苯丙氨酸(在较小程度上)残基,或者来自相同但位于蛋白质基质内不同环境的荧光团。α-胰凝乳蛋白酶α-chymotrypsin (α-chym)在295 nm选择性激发时,其8个色氨酸残基产生独特的荧光。这种辐射通常对周围环境非常敏感。在AOT反胶束等体系中,水的物理化学性质与散装水的物理化学性质大不相同,并可能导致蛋白质构象状态的变化。先前获得的涉及α-chym和单独Trp分子以及乙酰Trp衍生物的数据显示,上述三种分子在上述反胶束中的位置不同。
为了更好地研究α-chym与胶束内水的相互作用,使用纳秒分辨率的稳态和瞬态测量证明了含水量和初始 pH 值变化(从 7 到 10)的微小差异,并允许讨论,结果为不同类别的 Trp 残基。这些残留物的可及性以及它们与溶剂的暴露程度可以通过碰撞淬火进一步探测。使用极性溶质,但具有不同的尺寸,如丙烯酰胺和琥珀酰亚胺或带电溶质,如碘化物,可以绘制代表不同暴露类别的 Trp 残基的方案,以便阐明淬灭剂与蛋白质中暴露较少的残基碰撞的机制:蛋白质的渗透或折叠。
Andrade等人[1]在不同含水量和不同pHext下,获得了溶解在AOT反胶束中的α-chym的吸收和发射光谱,如图1所示。根据获得的数据,可以提出以下三类在α-chym中排放Trp残基的方法(图2显示了这三类残基的预测位置):(A)类将涉及蛋白质表面,约占总排放量的41%,寿命约为4纳秒,并且完全可以接触到丙烯酰胺和琥珀酰亚胺;(B)类将涉及 l-Trp 残基,这些残基也可能位于表面,但吲哚环朝向蛋白质内部。
因此,丙烯酰胺仍然可以获得该发射部分,但琥珀酰亚胺可获得,对蛋白质总排放的贡献约为 38%,寿命为 1.8纳秒。(C)类将涉及埋藏在疏水性较强的环境中的l-Trp残基,碘化物和琥珀酰亚胺几乎无法接近,丙烯酰胺也几乎无法接近。它们的重量约为 21%,寿命为 0.6纳秒。pH值的变化似乎并没有显着改变这一情况;仅在 AOT 反向胶束中,pHext = 10,带电界面似乎发生了某种重排,残基似乎变得更容易接近。
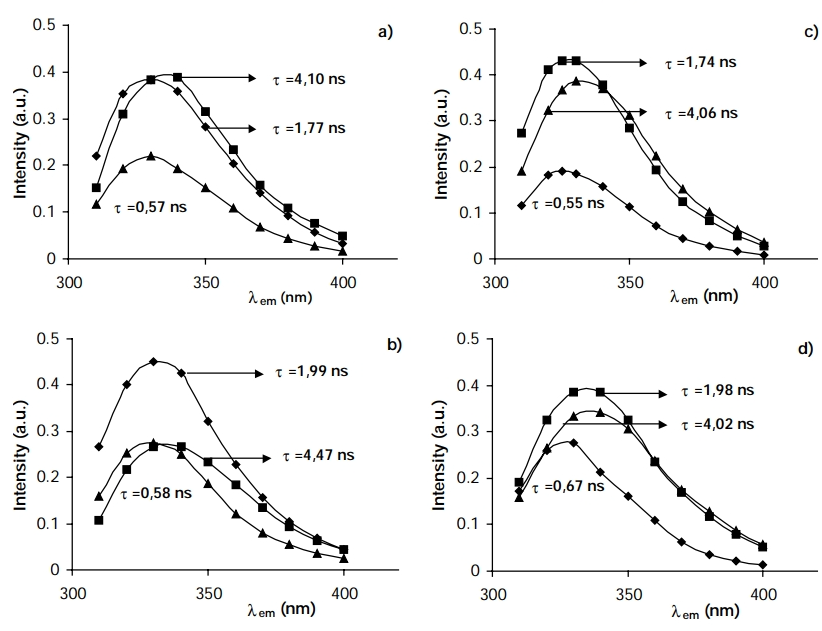
图1. a-chym在水中和在反向胶束中的衰变相关发射光谱[1]
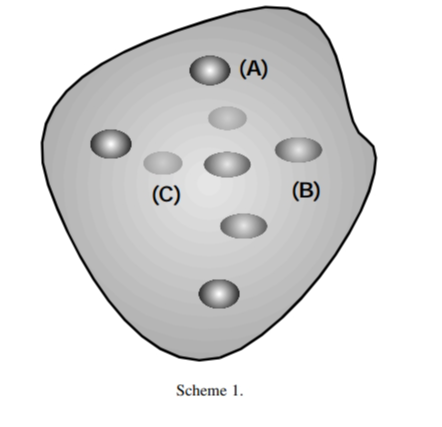
图2. 三类残基的预测位置[1]
[1] Andrade S M ,Sílvia M.B. Costa.Structural changes of α-chymotrypsin in reverse micelles of AOT studied by steady state and transient state fluorescence spectroscopy[J].Journal of Molecular Structure, 2001, 565:219-223.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,提供材料测试、高端测试、环境检测、生物服务、模拟计算、科研绘图、数据分析、试剂耗材、行业解决方案、指南针学院等多项科研产品和服务矩阵。企业致力于为高校、科研院所、医院、研发型企业等科研工作者,提供专业、快捷、全方位的检测及科研服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-09-26
2024-09-26
 1562
1562
 0
0










