【摘要】 复旦大学联合团队在《Nature Communications》发表研究,开发ZnAuPN双金属卟啉光电极实现高精度神经调控。科学指南针提供理论计算支持,助力电子转移机制解析与材料设计。
复旦大学步文博教授团队联合悉尼科技大学金大勇院士、华东师范大学陈缙缙教授在《Nature Communications》发表创新研究成果,开发新型双金属卟啉光电极(ZnAuPN),实现超快电子转移与高精度神经调控。科学指南针为本研究提供理论计算支持,助力电子转移机制解析与材料设计优化。
研究背景与神经调控挑战
随着脑科学研究和神经退行性疾病治疗需求增加,实现单个神经元和神经网络的高时空精确调控具有重要意义。现有神经调控技术存在基因依赖性和侵入性强的局限,亟需开发新型非侵入式精准调控技术。
核心技术瓶颈:
-
光遗传学技术依赖基因转染和高强度激光刺激
-
传统光电设备与神经元尺寸不匹配,电荷注入效率低
-
器件尺寸缩小导致光电性能显著降低
-
需要高精度、高时效性的神经界面技术
创新方法:双金属卟啉异质结设计
研究团队通过离子交换策略开发锌金双金属卟啉光电极(ZnAuPN),利用超快电子转移实现高效神经电刺激。
技术突破要点:
-
离子交换策略实现锌金原子级替代,构建异质结结构
-
双金属协同效应促进光生载流子分离与传输
-
电子聚集至AuP⁺中心,实现稳定电荷注入
-
宽光谱吸收和双光子特性增强组织穿透能力
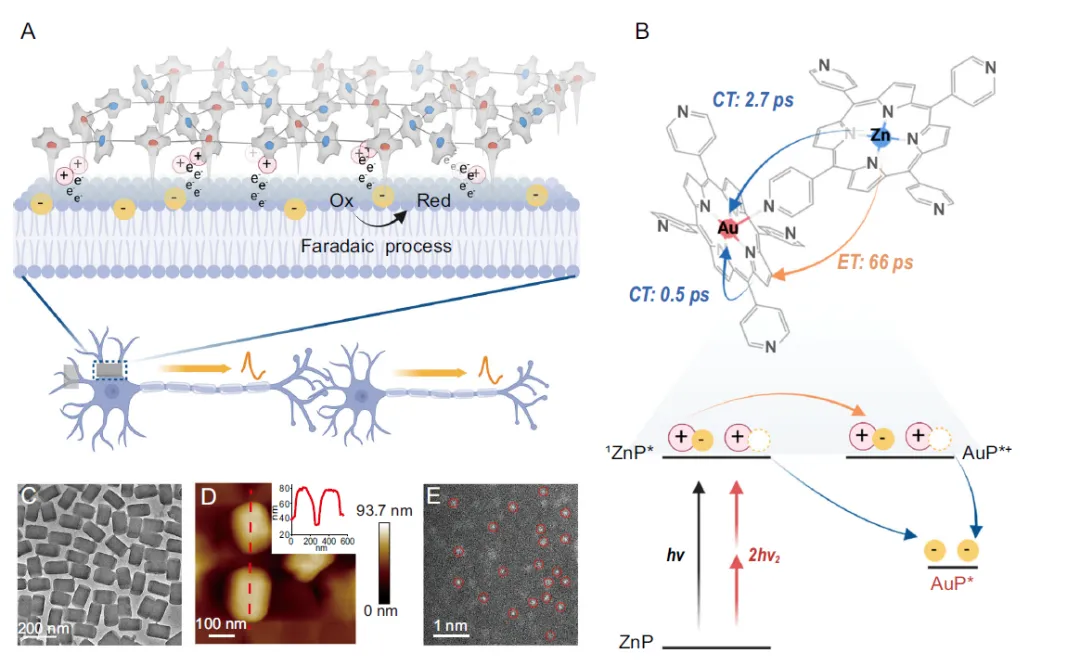
图1 ZnAuPN的设计与合成
材料合成与结构表征
通过自组装和离子交换法成功制备ZnAuPN纳米片,系统表征证实其晶体结构和化学组成。
结构特征验证:
-
HRTEM和XRD显示与ZnPN相同晶体结构,保持纳米片形态
-
XPS和XANES证实Au以+3价态存在,原子级分散
-
Au-N配位方式表明金属原子高度分散
-
可见光谱红移证实Soret带和Q带跃迁效应
-
双光子吸收截面提升至4369 GM,增强深层组织激发
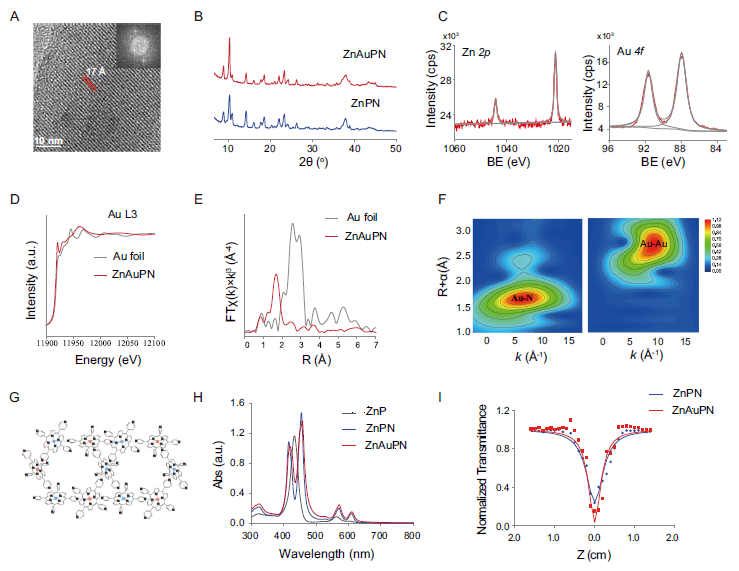
图2. ZnAuPN的表征
光电性能与电子转移机制
理论计算深入揭示ZnAuPN的超快电子转移机制和能量转换原理。
机制研究突破:
-
稳态荧光显示ZnP本征荧光淬灭率达97%
-
能量和电子转移速率高达1.485×10¹¹ s⁻¹
-
瞬态吸收光谱证实激发态特性改变
-
前沿轨道分析显示HOMO位于ZnP,LUMO位于AuP
-
光激发后ZnP*向AuP发生超快电荷转移
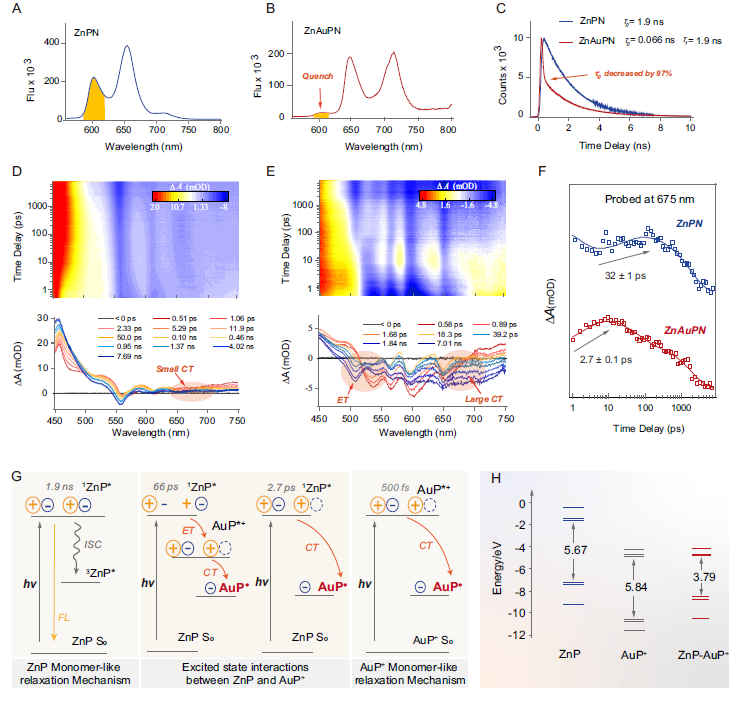
图3. 光激发下ZnAuPN的能量和电荷转移
光电流与神经电生理响应
通过膜片钳技术评估ZnAuPN光电性能,证实其高效光电流产生和神经电活动调控能力。
性能卓越表现:
-
光激发下光电流输出能力显著增强
-
561nm激光照射诱导细胞内钙信号瞬时上升
-
800nm飞秒激光同样有效激活神经活动
-
670nm激光刺激诱发系列动作电位产生
-
短期突触可塑性显著增强
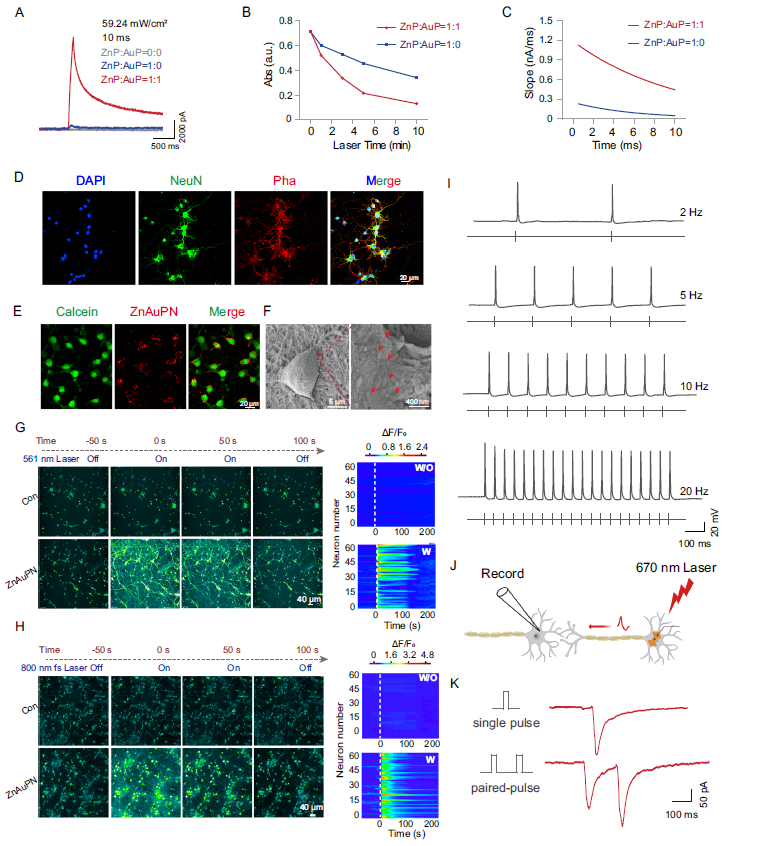
图4. ZnAuPN的光电流测量和在大鼠皮层初级神经元中的神经调节作用
体内神经调控效果验证
通过体内实验验证ZnAuPN在活体神经调控中的效果,展示其实际应用潜力。
体内性能表现:
-
670nm激光照射下神经元发放频率从10Hz提升至45Hz
-
运动皮层活动显著增强,调控效果明显
-
旷场实验显示小鼠运动距离显著增加
-
800nm双光子激发有效调节后肢肌电信号
-
运动皮层c-fos表达显著激活,分子层面验证有效性
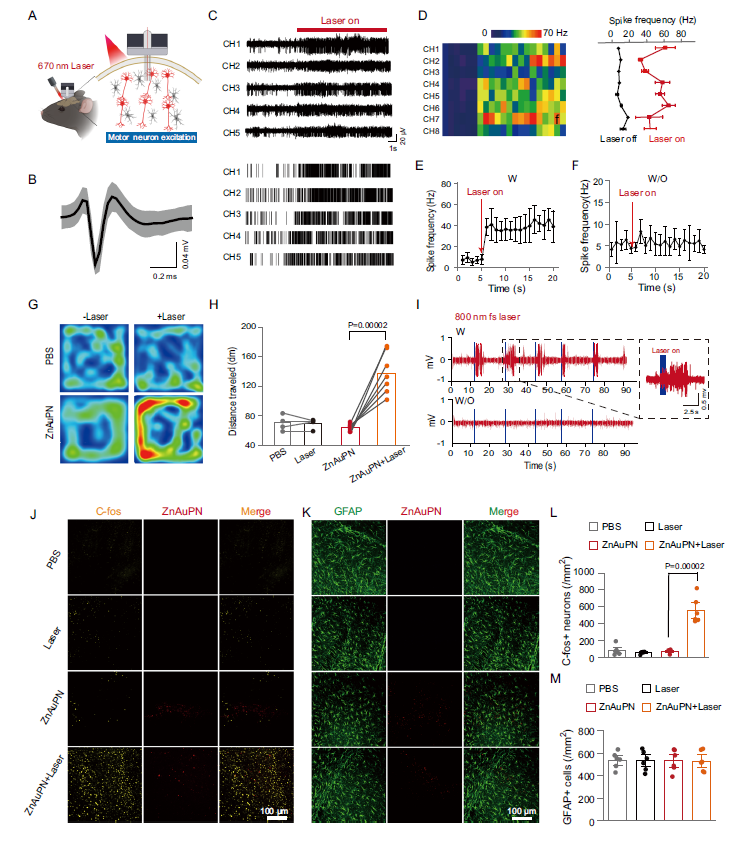
图5. 颅外670 nm激光和800 nm激光对小鼠运动皮层的神经调节作用
生物相容性与安全性评估
系统评估ZnAuPN的生物相容性和长期安全性,确保其临床应用可行性。
安全性验证结果:
-
不同处理组间GFAP表达无显著差异
-
未引起胶质增生或脑部炎症反应
-
细胞活性和组织状态保持正常
-
长期植入显示良好生物相容性
-
为临床转化提供安全性保障
总结与展望
本研究开发的双金属卟啉光电极为高时空精度神经调控提供创新解决方案,推动神经接口技术发展。
创新价值总结:
-
首创双金属卟啉异质结结构,实现超快电子转移
-
原子级分散金属中心增强电荷注入效率
-
双光子特性提升深层组织调控能力
应用前景:
-
为神经退行性疾病治疗提供新工具
-
推动脑机接口技术向高精度发展
-
为其他光电调控技术提供设计借鉴
-
促进神经科学研究与临床治疗创新
论文信息:Nature Communications, 2024, 15, 10241
DOI:10.1038/s41467-024-54325-8
科学指南针计算服务:提供理论计算与分子模拟支持,助力光电材料设计与生物医学应用研究。了解更多:https://www.shiyanjia.com/simulate.html【科学指南针·服务声明·2025】











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-11-17
2025-11-17
 793
793
 0
0










