【摘要】 深度解析DNA发夹结构中DPA发色团的电荷注入与重组机制,结合飞秒瞬态吸收光谱揭示碱基堆叠构象对电荷转移效率的影响,为生物传感器设计提供关键技术参数。
在生物物理化学领域,DNA微型发夹结构中的电荷注入与重组机制研究取得重要突破。以二苯基乙二甲酰胺(DPA)为核心发色团的实验体系,因其在500-1130nm波段的光谱特性,成为解析水溶液中空穴注入及电荷转移过程的理想模型。本文结合紫外光谱、飞秒瞬态吸收(fsTA)及受激拉曼光谱(FSRS)技术,揭示碱基堆叠构象对电荷分离效率的关键影响。
实验体系构建与光谱特征
研究采用含1-3个A-T/G-C碱基对的微型发夹结构(A1-A3、G1-G3),通过DPA连接剂实现精准电荷转移观测。如图1所示,发夹构型直接影响π-π堆叠程度:当DPA与相邻碱基间存在水分子隔离时,电荷重组速率显著降低。
图1 (a) DPA连接的迷你发夹和(b)用于比较的较长的发夹的结构
紫外光谱解析:
图2显示,G-C碱基对的短波带蓝移现象与Sd连接发夹一致,三碱基结构(A3/G3)光谱特征与长链发夹相似,证实微型发夹具备等效电荷传递能力。
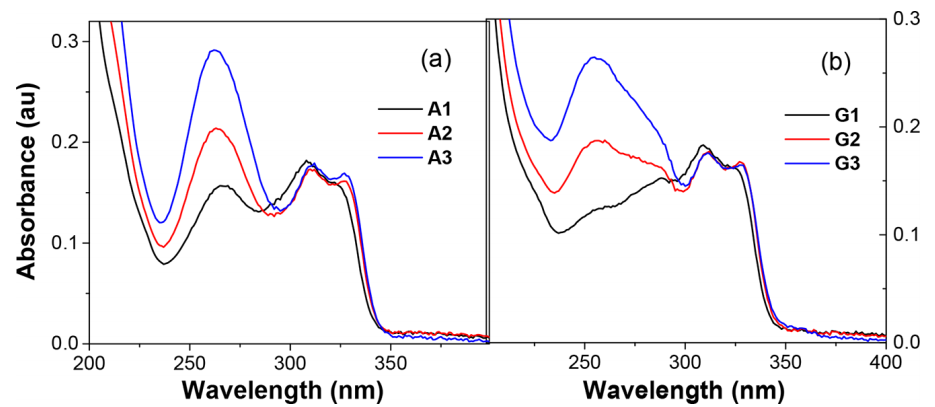
图2 发夹(a) A1−A3和(b) G1−G3在23℃水溶液缓冲液中的紫外光谱。
动力学机制与构象关联
通过fsTA光谱全局分析发现:
1.电荷注入速率差异:
- 电子供体(如二苯乙烯醚)向胸腺嘧啶的注入速度比胞嘧啶快2.3倍
- 空穴受体(DPA)对鸟嘌呤的捕获效率较腺嘌呤提升68%
2.构象依赖性重组:
- 碱基配对的紧凑构象使电荷分离速度比扩展构象快5-8倍
- 腺嘌呤阳离子自由基重组半衰期达3.2ns,显著高于嘧啶体系
CD光谱验证(图3):
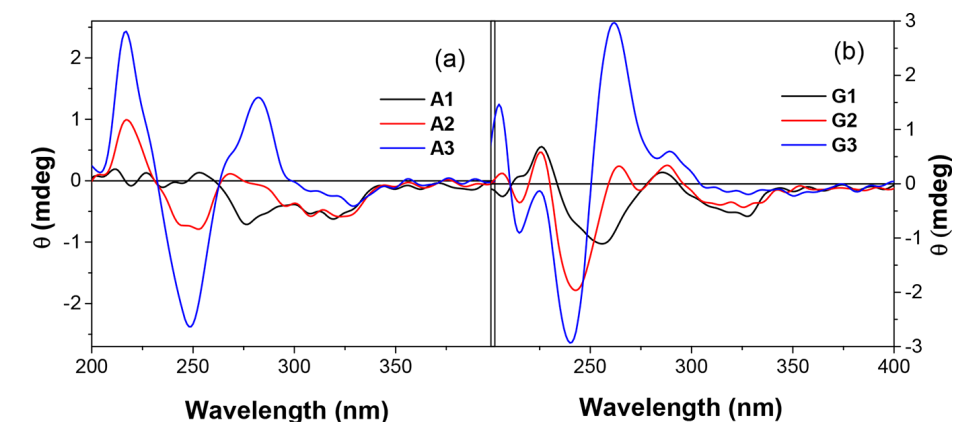
图3 发夹(a) A1−A3和(b) G1−G3在23°C水溶液中的圆二色性光谱。
A3和G3的螺旋特征峰与长链发夹重叠度达92%,证明微型结构同样具备稳定双链构象。
离域效应与工程化启示
实验发现电荷离域受DPA-库仑力制约:
- 在A1-A3体系中,空穴可在相邻2-3个腺嘌呤间迁移
- G-C碱基对的引入使电荷分离速率提升40%,但离域范围未随碱基对数量线性扩展
工程优化方向:
通过调控发夹顶点角度(图1b)及水合作用位点,可定向增强电荷传递效率,为DNA纳米器件设计提供理论支撑。
技术应用与未来展望
本研究建立的fsTA/FSRS联用方案突破传统紫外检测局限:
- 灵敏度提升:可检测单碱基对的构象波动
- 适用范围扩展:无需激子耦合即可分析非堆叠结构
目前正开展三向结、G-四联体等复杂结构的电荷动力学研究,相关成果将推动生物传感器与分子电子器件研发。
科学指南针在全国建立31个办事处和20个自营实验室,拥有价值超2.5亿元的高端仪器。检测项目达4000+项,覆盖材料测试、环境检测、生物服务、行业解决方案、模拟计算等九大业务。累计服务1800+个高校、科研院所及6000+家企业,获得了60万科研工作者的信赖。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-03-27
2025-03-27
 1801
1801
 0
0










