【摘要】 深度解读电荷重组引发的单体蛋白弱本征发光现象,揭示ProCharTS吸收带与带电氨基酸的关联机制,分析人血清白蛋白(HuSA)、α-突触核蛋白等典型样本的光谱特性及实验数据。
近年研究发现,特定结构的单体蛋白质在紫外-可见光区(250-800nm)展现独特吸收特征,这一现象被命名为蛋白质电荷转移光谱(ProCharTS)。尤其值得关注的是,Lys/Glu等带电氨基酸侧链在多肽主链间形成的电荷转移网络,为揭示蛋白质弱本征发光机制提供了新视角(见图1A)。
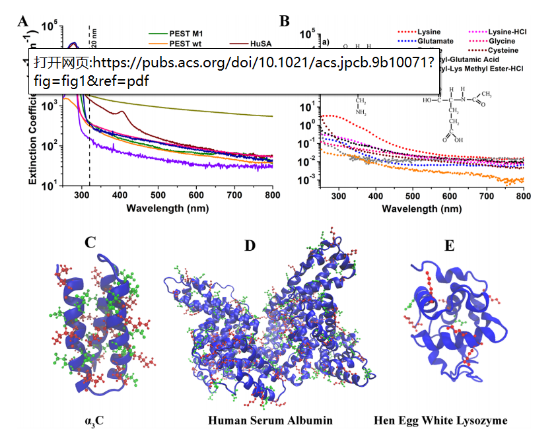
图1 ProCharTS吸收光谱及消光系数图
核心机制:电荷重组驱动发光
实验证实,当蛋白质携带密集的带电氨基酸时,光诱导电子转移会产生微弱发光。以人血清白蛋白(HuSA)为例,其404nm处的特征峰(图1D)及长尾吸收,证实了赖氨酸-谷氨酸空间相互作用的特异性。
关键发现:三类蛋白质发光特性对比
1.折叠高密度型(HuSA/α3C)
- 带电残基占比>25%
- 吸收光谱覆盖全波段(250-800nm)
- 量子产率稳定在0.03±0.005
2.折叠低密度型(HEWL)
- 带电残基<15%
- 320nm后吸收锐减(图1E)
- 发光强度降低60%
3.无序结构型(PEST片段/α-synuclein)
- 空间相互作用弱
- 吸收强度仅为折叠蛋白的1/3
- 斯托克斯位移达120nm
实验验证:浓度依赖性的双重证据
通过梯度浓度测试(HuSA 1-200μM,α-synuclein 0-40μM)发现:
- 吸光度与浓度呈严格线性关系(R²>0.99)
- 发光强度/[蛋白]比值与带电残基密度正相关
- 排除聚集干扰:50μM以下保持单体态(图2)
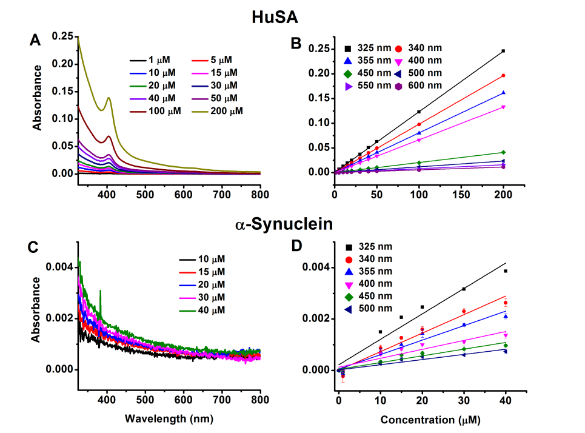
图2蛋白质间吸光度与浓度线性关系图:不同浓度的HuSA(峰值在404 nm)和α-突触核蛋白的吸收光谱分别如图a和C所示。HuSA (B)和α-Synuclein (D)在不同波长下的吸光度分别为1µM ~ 200µM的HuSA和10µM ~ 40µM的α-Synuclein。
技术突破:排除传统干扰因素
针对250-325nm波段与芳香族氨基酸吸收重叠的问题:
- 采用PESTwt等无芳香族蛋白建立参照系
- 通过氨基酸簇对照实验(图1B)验证ProCharTS特异性
- 确认600nm以上吸收源自Lys-Glu互作
参考文献:[1] J. Phys. Chem. B 2020, 124, 2731−2746
科学指南针在全国建立32个办事处和20个自营实验室,拥有价值超2.5亿元的高端仪器。检测项目达4000+项,覆盖材料测试、环境检测、生物服务、行业解决方案、模拟计算等九大业务。累计服务1800+个高校、科研院所及6000+家企业,获得了60万科研工作者的信赖。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-03-28
2025-03-28
 1936
1936
 0
0










