【摘要】 本文针对外泌体透射电镜(TEM)表征中的常见问题,如图像杂质多、结构不清晰等,详细解析正染色与负染色的机制、区别及应用场景,并提供细胞上清和血液样本的杂质去除策略,帮助研究者优化实验流程,获得高质量TEM图像。

众所周知,胞外囊泡作为细胞间通信的 "信使",在生理病理机制、临床诊断及药物递送等领域展现出巨大潜力。
然而在实际应用中,我们常会遇到,辛辛苦苦提取的外泌体做透射电镜(TEM)时,结果图像质量很差,充满杂质,杂质比外泌体还多,甚至提交了论文,审稿人却质疑电镜图片是否真的证明了囊泡结构?真的让人非常头疼。
看来,想揭开胞外囊泡的神秘面纱并不容易 —— 如何用透射电镜(TEM)看清它的真实模样?又该如何避免实验中杂质盖过囊泡的坑?
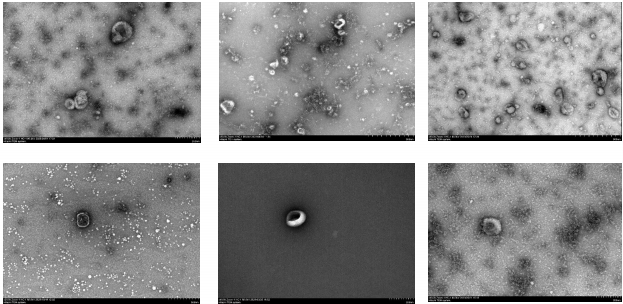
图注:充满杂质的TEM图像
用TEM看清外泌体的真实模样,有2种方式:正染色与负染色。那么,您的样本需要做正染色还是负染色?要了解电子染色后TEM形貌分析解读,我们必须需要了解正染色与负染色的特点和区别,才能判定哪种染色更能支持自己的实验结论。
①正染色:
机制:重金属盐(如醋酸铀酰、柠檬酸铅)与样品本身的组成成分(特别是膜上的脂质和蛋白质)结合,增加这些区域的电子密度。
图像特征:背景亮(电子穿透多),样品结构暗(电子散射多)。能清晰显示膜的“暗线”结构。
正染色是判断一个颗粒是否为膜性囊泡(如外泌体)而非单纯蛋白质聚集体的关键依据。
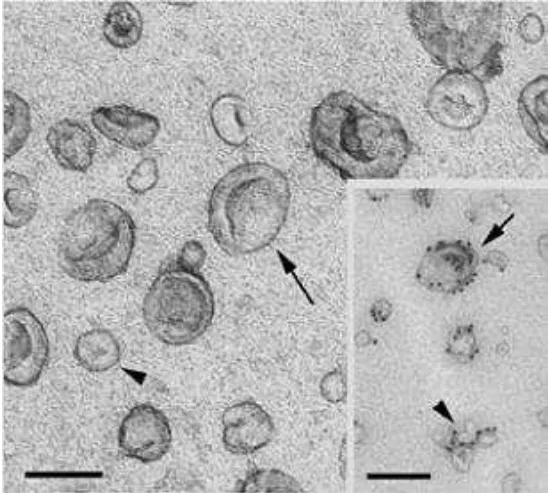
图注:正染色
②负染色:
机制:重金属盐染料将样品包裹,并填充其周围的凹陷处。染料本身是电子不透明的。
图像特征:背景暗(被染料覆盖),样品结构亮(电子可穿透)。由于染料在囊泡周围和塌陷中心堆积,形成了典型的杯状/茶托状外观,立体感极强。
需要注意的是,负染色显示的是颗粒的外部轮廓和拓扑结构,不能直接证明其是膜结构。
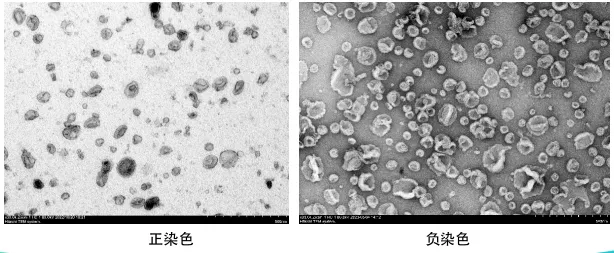
图注:正染色与负染色
那么,什么时候选择使用正染色?
当您的研究对象可能存在争议时(如区分外泌体和非膜性的蛋白质聚集体或脂蛋白:蛋白质聚集体在正染色下没有清晰的膜边界,而是均一的暗色团块);
当研究新型或非典型囊泡时,要确认其膜结构;
当您建立一种新的分离方法,并需要严格证明该方法确实能分离出膜性囊泡时。
提供正染色的照片,能为您“观察到的是外泌体/微囊泡”这一结论提供最强有力的证据,让审稿人无可挑剔。
什么时候负染色就足够了?
在大多数常规研究和日常实验中,负染色是首选,因为它更快捷、更直观。
日常实验的快速评估:在分离外泌体后,想快速知道样品里有没有囊泡、数量多不多、背景干不干净;或作为多种鉴定方法的一部分:当您的数据集中已经包括了Western Blot(标志蛋白)、NTA(粒径分布) 等功能学数据时,负染色提供的形貌照片作为辅助证据已经足够有说服力。
目前绝大多数论文中展示的漂亮、立体感强的“杯状”外泌体电镜图,都是负染色的结果,这已成为该领域的惯例。
不管哪种染色方法,如何避免实验中杂质盖过囊泡的坑?这个问题的解决策略是,必须提高样品纯度与浓度。
而对于不同的样品,也有不同的策略去去除杂质,我们以最常见的细胞上清和血液样本举例:
1.细胞培养上清:
主要杂质:细胞碎片、无定形蛋白质、血清中的脂蛋白(如果使用的血清未经过超速离心去除外泌体)。
解决方案:
保证细胞状态:使用低代次细胞,在对数生长期(80-90%汇合度) 收集上清,避免细胞过度融合和死亡。
使用“干净”血清:使用通过超速离心预处理过的无外泌体血清。
优化收集时间:换用无血清或低血清培养基后,收集时间不宜过长(通常12-48小时),以减少死细胞和碎片。
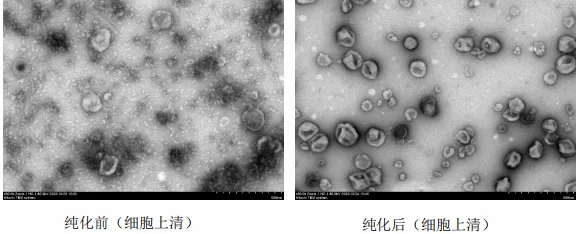
图注:细胞上清样品纯化前后对比
2.血清/血浆:
主要杂质:脂蛋白(如乳糜微粒、VLDL、LDL、HDL)、血清白蛋白等。
解决方案:
必须进行纯化。蔗糖密度梯度离心是去除这些杂质,尤其是与外泌体密度重叠的HDL的首选方法。
通过NTA测定,使用颗粒浓度做指标,其颗粒浓度建议 > 1 x 10^11 particles/mL,以保证在电镜网格的一个视野中能看到足够多的、有统计意义的囊泡。

图注:血清样品超离与纯化前后
生物电镜新客首单首样免费测
首样通通不花钱,扫码咨询立享优惠

扫码享优惠
首单首样免费测




 您已经拒绝加入团体
您已经拒绝加入团体

 2025-12-30
2025-12-30
 997
997
 0
0










