【摘要】 开发由两亲性药物分子自组装而成的含光热剂和抗癌药物的无载体纳米粒子是非常有吸引力的。
纳米级给药系统已成为光化学治疗中广泛应用的方法。然而,这些纳米级药物递送系统存在载体诱导的毒性、药物释放不受控制和药物运载能力低的问题。
因此,开发由两亲性药物分子自组装而成的含光热剂和抗癌药物的无载体纳米粒子是非常有吸引力的。Ao等人[1]在该研究中通过氧化还原反应的二硫连接剂将喜树碱(CPT)与光热剂新吲哚菁绿(IR820)偶联。如图1所示利用氧化还原反应二硫键将疏水药物CPT与亲水性光热剂IR820连接,形成了一种新的前药两亲体,命名为IR820- ss -CPT IR820-SS-CPT前体药物由于其固有的两亲性结构,可以通过自组装方法在水中自组装纳米颗粒。
图2中所示,治疗性前药IR820-SS-CPT通过四个步骤合成。得到的两亲性药物-药物偶联物(IR820- ss -CPT)在水溶液中可以自组装成纳米颗粒(IR820- ss -CPT NPs),从而显著提高了IR820的膜透性和CPT的水溶性。IR820-SS-CPT NPs中的二硫键可以在富含GSH的肿瘤微环境中被切割,导致偶联药物的随需释放。重要的是,IR820-SS-CPT NPs显示出极高的治疗剂装载效率(接近100%)。
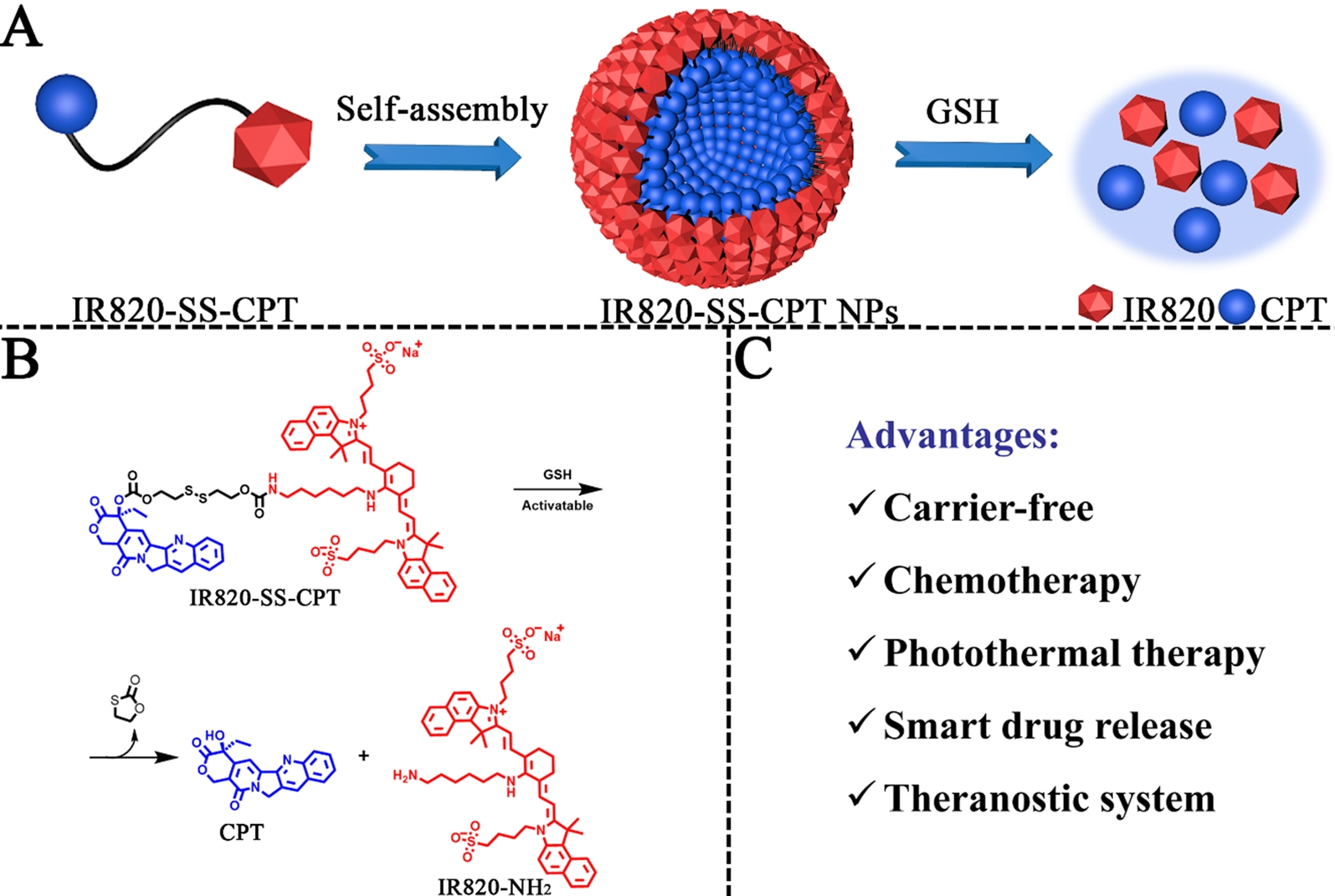
图1 化学光热治疗中氧化还原反应的IR820-SS-CPT NPs示意图

图2 IR820-SS-CPT的合成路线
为了解决这些问题,人们对建立能够共同递送两种或两种以上治疗剂的协同药物递送系统产生了极大的兴趣,以达到对抗肿瘤异质性的协同治疗效果。这些策略不仅可以利用不同的治疗方法显著增强抗肿瘤效果,还可以克服严重的不良反应。
近年来,化疗与光热联合治疗在癌症治疗领域备受关注。光热疗法(PTT)利用近红外(NIR)光热光剂吸收光能,可导致不可逆的肿瘤损伤。作为一种很有前景的癌症侵袭性治疗策略,热疗还可以通过增加细胞膜的通透性来改善肿瘤细胞对抗肿瘤药物的摄取,并提高细胞对化疗的敏感性[19,20]。
为了实现这一目标,许多纳米级药物递送系统已经被构建,用于光热剂和化疗药物的协同癌症治疗。虽然这些给药系统的协同效应已被许多研究证明,但它们在更广泛的应用中必须面对许多限制。由于过量使用附加赋形剂、载体相关毒性以及药物在血液循环中过早释放,这些给药系统的现状受到很大限制。
因此,开发具有高载药能力,在肿瘤部位精确释放药物和易于制造的新型纳米颗粒是迫切需要的。
此外,体外实验结果表明,IR820-SS-CPT NPs具有显著的肿瘤细胞杀伤效率。特别是IR820-SS-CPT NPs在体内表现出优异的抗肿瘤作用。体外和体内实验表明,设计的IR820-SS-CPT NPs可以为化学光热治疗提供有效的纳米治疗药物。
综上所述,该研究开发了一种新型可活化的两亲小分子前药IR820-SS-CPT,它将gsh触发的药物释放、高治疗剂含量、化学-光热联合治疗的多重优势整合到一个给药系统中。
[1]. Ao, M. T.; Yu, F.; Li, Y. X.; Zhong, M. Y.; Tang, Y. H.; Yang, H.; Wu, X. J.; Zhuang, Y. F.; Wang, H. Y.; Sun, X. L.; Hong, X. H.; Chen, X. D., Carrier-free nanoparticles of camptothecin prodrug for chemo-photothermal therapy: the making, in vitro and in vivo testing. JOURNAL OF NANOBIOTECHNOLOGY 2021, 19 (1).
科学指南针以分析测试为核心,提供材料测试、环境检测、生物服务、模拟计算、科研绘图等多项科研产品,累计服务1800+个高校、科研院所及6000+家企业,获得了60万科研工作者的信赖。始终秉持“全心全意服务科研,助力全球科技创新”的使命,致力于为高校、院所、医院、研发型企业等科研工作者提供专业、快捷、全方位的服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-07-31
2024-07-31
 3069
3069
 0
0










