【摘要】 《模拟计算指南》由唯理计算工程师团队历时7年打造,是计算化学领域的实用宝典。本书获复旦大学刘智攀教授(长江学者)和华南师范大学赵纪军教授(长江学者)高度评价,强调其“多维度理论支持”和“初学者友好性”。

关于本书
《模拟计算指南》是唯理计算工程师团队沉淀7年实战经验、历时一年打造,是一本计算化学快速入门指南、材料模拟计算领域的实用宝典。
“书中详细介绍了从理论计算化学的基本原理到目前国际前沿应用体系的计算模拟思路和方法,有利于读者从多维度理解如何采用理论计算方法来解决复杂科学问题,并帮助初学者从中找到适合自己科研的理论支持和计算解决方案。”
——教育部长江学者、杰青、复旦大学教授
刘智攀
“本书以其实用性和易学性为特色,无论是计算物质科学的初学者还是资深研究者,都能从中获得独特的视角和丰富的知识资源,使其成为该领域内一本极具价值的入门及参考书籍。”
——教育部长江学者特聘教授、华南师范大学教授
赵纪军

↑扫码了解更多书籍及唯理计算信息
01文章介绍
今天我们介绍下《模拟计算指南》的4.2 ETS-NOCV与CDA。
ETS-NOCV(extended transition state-natural orbitals for chemical valence)是Ziegler等22人提出的电子结构分析手段。它可以用于分析两个片段的轨道相互作用,将其分解为若干轨道对,每个轨道对中的两个轨道来源于同一组轨道作用,与成键和反键轨道的意义相仿。乍看起来,ETS-NOCV将轨道作用分解为一系列轨道对的效果与NBO相似,但事实上两者有着本质的不同。NBO是先得到分子整体的LP、BD、BD*等轨道,再研究这些轨道之间的超共轭作用,是基于分子整体的电子结构再分解到原子之间,并非直接分解到两个片段之间。此外,Gaussian自带的NBO分析并不能得到每一组BD、BD*等所贡献的能量;如果在NBO中想得到某一组轨道作用的相互作用能量,最直接相关的是超共轭分析,而这是将超共轭作为微扰进行处理;既然是微扰,其尺度就不能太大,对应E(2)的尺度在几个kcal/mol量级时比较可靠,而一旦输出内容中给出几十个kcal/mol或更大的能量,往往意味着这组相互作用不适合用NBO分析。而ETS-NOCV则没有该顾虑,它非常适合研究化学成键等能量尺度很大的场合。
以下用图4.5中NHC-AgCl配合物为例子,来展示ETS-NOCV的基本过程和结果。
在PBE0-D3BJ/def2-SVP水平下,对NHC-AgCl进行构型优化。整个分子为闭壳层单重态,Ag呈现直线二配位构型。Ag—C键长为2.070Å,Mayer键级为0.73,可见成键不是很强。接下来我们希望知道NHC与Ag之间成键的本质。NHC的碳原子上有一对sp²孤对电子可以作为给体,与此同时环上的π轨道可能与Ag存在反馈作用,除此之外也不排除其他相互作用。我们希望探究这些轨道作用对于整体成键的贡献究竟孰轻孰重。
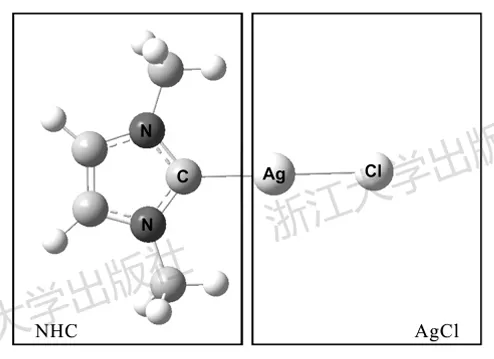
图4.5 一个NHC-Ag配合物的几何结构及片段划分
在进行ETS-NOCV之前,作为上一节的补充,我们先来观察这个分子的NBO轨道情况。图4.6展示了NBO得到的一些与C—Ag键有关的定域化轨道,容易发现轨道的形状与上一节介绍的轨道有明显不同,它们不再像标准的NBO轨道那样定域在两个原子之间了。而且相关轨道的数量也很多,如果武断地说有如下4种不同类型的BD轨道,C—Ag之间就存在4组轨道相互作用,乃至形成了四重键,显然是不合理的。这体现出了上一节提到的NBO对于以过渡金属配合物为代表的电子结构复杂、离域性较强的体系的局限性。
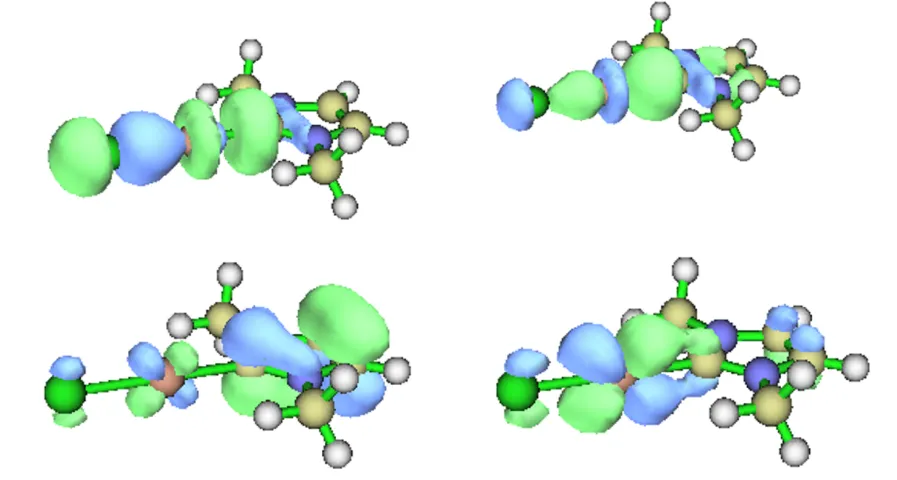
图4.6 NHC-Ag配合物的部分NBO轨道
接下来我们转而用ETS-NOCV进行分析。将分子分为NHC和AgCl两个片段。ETS-NOCV需要基于整体和各片段在合适计算水平下的单点计算所产生的fchk文件,通过Multiwfn处理得到。对两个片段进行单点计算后,载入Multiwfn,即可生成一系列NOCV信息(节选),如图4.7所示。
.jpg)
图 4.7 NHC-Ag配合物的 ETS-NOCV 输出信息(部分)
其中的本征值可近似看作在轨道组合时转移的电子数,在第一个轨道对中,标号为1的NOCV轨道对贡献了-35.52kcal/mol的结合能,由第1个和第187个NOCV轨道组成。我们将标号为1~3的NOCV轨道对涉及的轨道进行可视化,如图4.8所示。
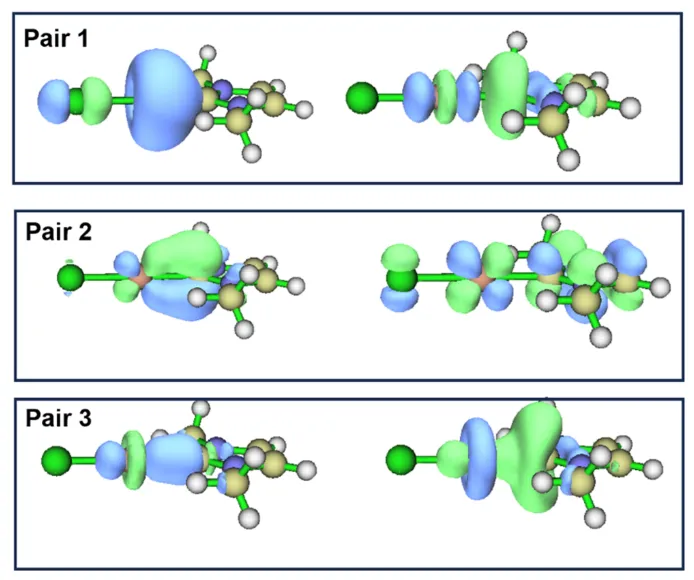
图4.8 NHC-Ag配合物的几组主要NOCV轨道
容易发现,轨道对1~3分别对应了Ag与NHC之间形成的2种σ键和1种π键。其中Pair1由Ag的sp杂化轨道与NHC的sp²孤对电子构成,Pair3则主要由Ag的dz2轨道贡献,而Pair2则对应Ag的d轨道与配体π*构成的反馈π键。虽然有三组相互作用,但三者的强度相差悬殊,Pair1的能量贡献占据了绝大多数,Pair2和Pair3的能量贡献加起来也只有Pair1的1/3左右,因此可以知道,在这个NHC配合物中,Ag和配体主要形成σ键,反馈作用比较微弱,这也和较弱的键级相符合。
除了对轨道进行可视化之外,还可以得到每个NOCV轨道对带来的电子密度改变,即NOCV pair density。它反映了这组轨道作用形成过程中电子的转移情况。在图4.9中,蓝色和绿色等值面分别表示失去和得到电子。可以清晰地看出,Pair1中配体作为σ给体将电子转移给Ag,而Pair2和Pair3均表现出Ag向NHC的反馈。有趣的是,Pair3的反馈与通常的反馈π键不同,综合轨道形状判断,可以看作是一种新奇的d(Ag)到σ*(C—N)的反馈σ键。前述NOCV轨道的本征值可近似看作电子转移的数量,因此这三组轨道作用分别导致了Ag得到0.44个电子,又失去0.23个和0.15个电子。事实上,这类反馈σ键正是Hii等人借助ETS-NOCV工具在2015年报道的。
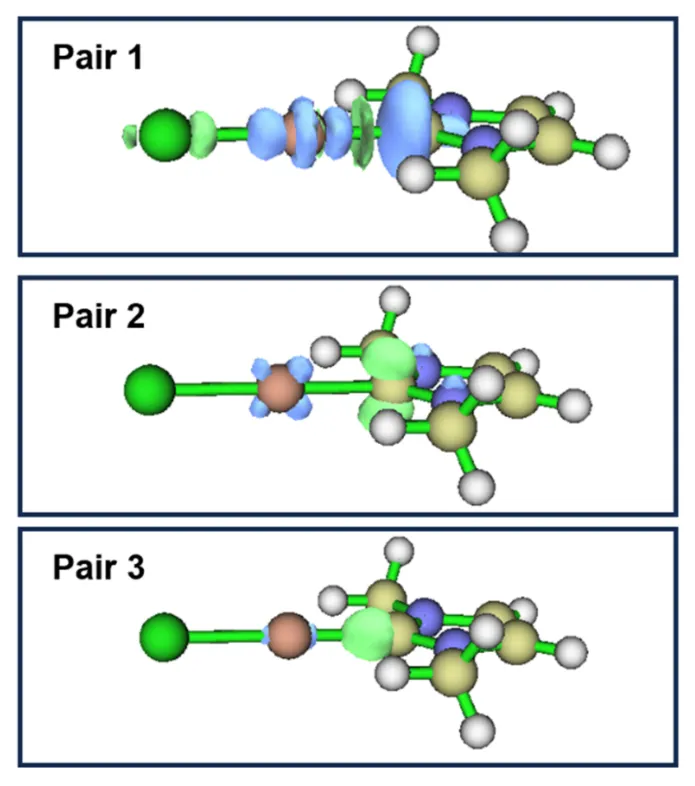
图4.9 NHC-Ag 配合物的部分 NOCV pair density
ETS-NOCV是分析片段间轨道作用的一个利器,另一个利器是电荷分解分析 (charge de-composition analysis,CDA)。它同样将分子拆分成片段,用于研究片段之间的轨道相互作用,但它的效果与 ETS-NOCV不同,能得到来自片段的轨道之间的组合情况,在特定的情况下可以得到轨道作用的图解。但事实上,这样得到的图解往往非常复杂,涉及相当多的轨道相互作用,很难辨认。仍以上述NHC配合物为例,CDA分析后得到如图4.10所示轨道作用图解。
.jpg)
图4.10 NHC-Ag配合物的CDA分析结果(部分)
其中存在大量轨道相互作用,并非所有的都能与人们熟悉的化学观念对应。例如,其中存在许多占据轨道之间或空轨道之间的相互作用,它们对化学成键贡献不大,但密密麻麻,极大地稀释了人们的注意力。因此,虽然CDA可以得到轨道图解,但绝不能替代对分子轨道理论的掌握。绝大多数情况下,分子轨道图解都是可以通过定性分子轨道理论的知识徒手画出来的,能通过CDA直接得到的例子并不多。
CDA分析很重要的意义是可以用于得到片段间的电子转移,这与ETS-NOCV类似。对于上述NHC配合物,CDA分析得到NHC向Ag转移(donate)了0.2729个电子,而Ag向NHC反馈(back-donate)了0.0411个电子,总体上存在NHC向Ag的净电荷转移,数量为0.2318个。由于CDA与ETS-NOCV遵循不同的原理,而电荷转移的数量,特别是donate与back-donate的划分,实际上是为了贴合化学家关于配位键与反馈键的观念而人为确定的,因此不同的分析手段得到的电荷转移数量也不同,而人们讨论这一点,大多数情况下是为了对比一系列配体作为给体和受体的能力,基于不同方法,往往能得到定性一致、互相佐证的结论。

多位专家力荐 超全实战指南



↑扫码了解更多书籍及唯理计算信息











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-07-22
2025-07-22
 2554
2554
 0
0










