【摘要】 由于其独特的光学特性和易于制备的特点,碳基纳米材料在生物领域得到了广泛的关注。
光声成像技术是近年来发展起来的一种新型成像技术。它是一种基于光声效应的生物/医学成像方法的混合模式。在光声成像中,通常需要脉冲激光来照亮成像部位。被吸收的光能会转化为热能,引起附近组织的热膨胀,形成宽带(兆赫)超声波。这种超声波可以被超声波换能器检测到。与传统的荧光成像相比,磁共振成像、超声成像、正电子发射断层扫描(PET)成像技术具有实时性、空间分辨率高、不使用有害辐射等优点。光声成像可用于内源性造影剂(如血红蛋白、氧化血红蛋白、黑色素、荧光蛋白)的成像;但由于某些疾病(如乳腺癌、胶质瘤等)不产生内源性造影剂,因此无法实现对这些疾病的诊断。为了能够检测到这些疾病,外源性造影剂越来越受到科研工作者和医疗从业者的青睐。近年来,随着纳米技术的发展,光声成像中可用于外源性造影剂的纳米材料也越来越多。
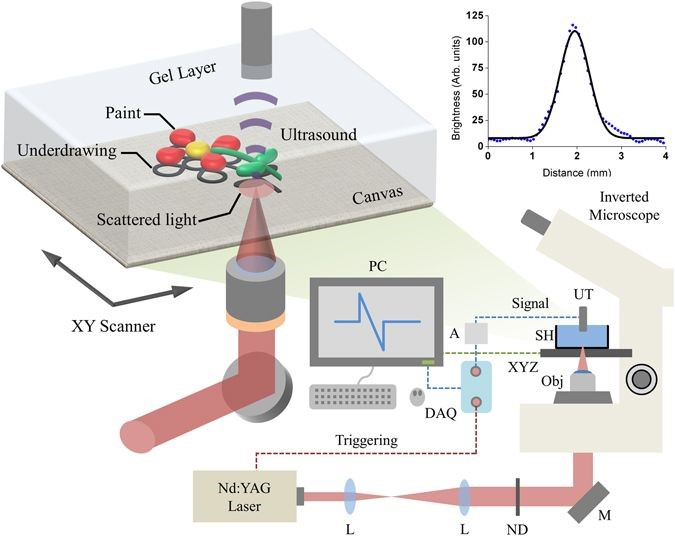
图 1 :光声成像装置和样品配置
碳基纳米材料
由于其独特的光学特性和易于制备的特点,碳基纳米材料在生物领域得到了广泛的关注。在拉曼检测、荧光成像、体内光声成像等生物成像领域,碳纳米材料已被用作光学试剂。碳纳米材料主要分为石墨烯和单壁碳纳米管两大类,均可作为光声成像造影剂。
金纳米材料
金纳米材料,如金囊泡、金纳米笼、金纳米颗粒等,在诊断医学中引起了大家的关注。金纳米材料依赖于近红外范围(700~900nm)的可调散射和吸收,因此,是光声成像的良好造影剂。同时,金基纳米材料可以吸收光能,并通过朗道阻尼效应将光能高效地转化为热能。这些材料在光热治疗(PTT)领域引起了极大的兴趣。基于金纳米材料的这些独特性质,它们可以进一步用于近红外激发下控制亲水药物的释放。当药物在目标方向上的目标位置释放时,可以通过光声成像技术对金纳米材料进行监测。用金纳米材料装载治疗药物的可能性,为其治疗应用提供了极大的好处。
共轭聚合物纳米材料
近年来,高分子纳米材料主要作为纳米载体用于药物递送研究。这些高分子纳米材料具有良好的生物相容性,可以通过靶向有效地将药物递送到肿瘤部位。然而, 最近的研究发现,共轭聚合物纳米材料还具有独特的光学特性(如近红外吸收), 这使得它们可以用作光声成像的造影剂。
光声增强复合纳米材料
光声增强复合纳米材料是将不同种类的纳米材料通过不同的方法组合在一起,以达到增强光声信号和减少造影剂用量的目的的复合材料。例如,如果我们首先通过吸附技术将近红外染料吸附在单壁碳纳米管上,然后对碳纳米管表面的PEG进行修饰以增强其生物相容性,然后对PEG中的靶多肽(RGD)进行进一步修饰,我们会发现最终的复合纳米材料可以有效地增强光声信号。
总之,纳米粒子在光声成像中的应用极大地促进了光声成像技术的发展。光声成像技术的关键是光声成像造影剂。目前,对光声成像造影剂的研究主要集中在两个方面。一方面,研究人员寻求通过化学改性或与其他功能材料结合,对现有光声成像材料进行改进,形成新的多功能功能。另一方面,他们也在不断开发新型高效的光声成像造影剂,在克服传统造影剂缺点的同时,可以实现更高的光声成像效率。
在纳米材料赋能光声成像技术的创新浪潮中,研发人员推出了一系列专为光声成像设计的纳米产品。这些纳米探针不仅具备优异的光学吸收与声学转换效率,还展现出良好的生物相容性和靶向性,为光声成像提供了前所未有的灵敏度和分辨率。
现在科学指南针商城已上架相关商品,欢迎大家咨询选购:
下单链接
阿拉丁石墨烯:https://mall.shiyanjia.com/product-detail.html?product_id=20261&category=1
https://mall.shiyanjia.com/product-detail.html?product_id=19931&category=1
阿拉丁高纯石墨烯:https://mall.shiyanjia.com/product-detail.html?product_id=1328960&category=1
阿拉丁单壁碳纳米管:
https://mall.shiyanjia.com/product-detail.html?product_id=1348527&category=1
https://mall.shiyanjia.com/product-detail.html?product_id=1348511&category=1
参考文献
1.Xu, M., & Wang, L. V. (2006). Photoacoustic imaging in biomedicine. Review of Scientific Instruments, 77(4), 305-598.https://doi.org/10.1063/1.2195024
2.Filonov, G. S., Krumholz, A., Xia, J., Yao, J., Wang, L. V., & Verkhusha, V. V. (2012). Deep‐tissue photoacoustic tomography of a genetically encoded near-infrared fluorescent probe. Angewandte Chemie International Edition, 51(6), 1448-1451.https://doi.org/10.1002/anie.201107026
3.Li, K. , & Liu, B. . (2014). Polymer-encapsulated organic nanoparticles for fluorescence and photoacoustic imaging. Chemical Society Reviews, 43(18), 6570. https://pubs.rsc.org/en/content/articlehtml/2014/cs/c4cs00014e











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-08-21
2024-08-21
 3289
3289
 0
0










