【摘要】 本文详解抗体亲和冷冻电镜网格技术原理,涵盖标准化操作流程、电场辅助富集方案及在病毒学、蛋白质动力学研究中的创新应用,助力低浓度样本的高效结构解析。
在生物大分子结构解析领域,基于抗体的亲和冷冻电镜网格技术正成为突破性解决方案。该技术通过靶向富集低浓度样本,成功克服了传统冷冻电镜对高浓度样品的依赖,为病毒学、蛋白质动力学研究开辟新路径。
一、技术原理与核心优势
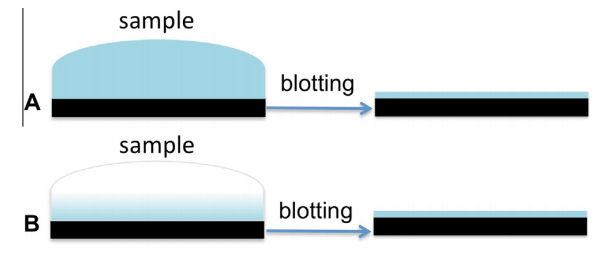
图1 在冷冻前在规则和亲和TEM网格上进行样品印迹。(A)常规TEM网格上的高体积浓度样品。(B)低浓度样品集中在亲和TEM网格表面。
传统冷冻电镜技术需1mg/ml以上样本浓度(如病毒悬液),而抗体亲和网格技术通过以下创新实现突破:
1.靶向捕获:碳膜表面修饰蛋白A/G,定向固定抗体形成"分子陷阱"
2.浓度放大:样本缓冲液中靶标颗粒被特异性捕获,浓度提升10-100倍
3.流程整合:同步完成样本纯化与制样,减少降解风险(Yu et al., 2016)
二、标准化操作流程
2.1 网格预处理
(1)抗体固定:50μl/ml蛋白A溶液室温孵育10分钟(IgG类抗体建议改用蛋白G)
(2)抗体负载:移取3-5μl抗血清/纯化抗体,湿度控制下反应15分钟
(3)缓冲清洗:PBS冲洗10-30秒去除未结合抗体
2.2 样本富集优化
- 被动扩散法:适用于≥10^8颗粒/ml样本,孵育30-60分钟
- 电场辅助法(创新点):
- 介质电泳:中性分子通过极化迁移加速富集
- 电泳富集:负电性生物大分子向阳极定向移动(pH7.0缓冲体系)
三、技术突破与应用场景
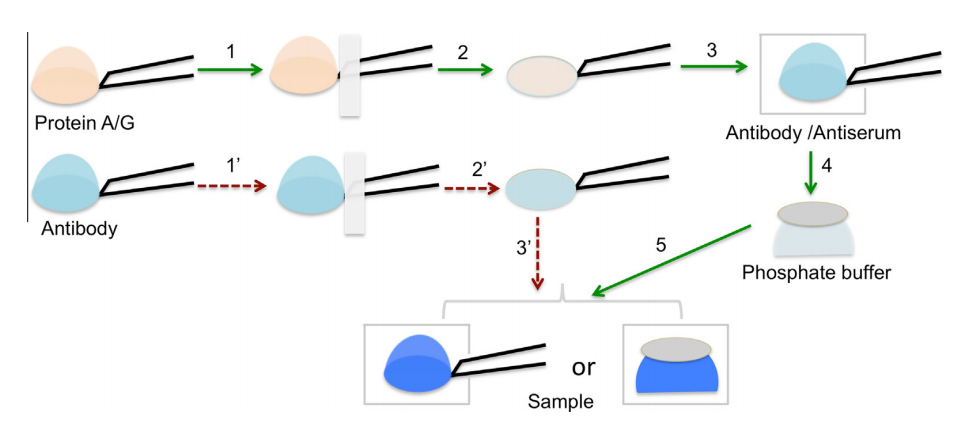
图2 SPIEM辅助低温电镜样品制备原理图。
1.低丰度样本:成功解析10^7颗粒/ml的病毒衣壳中间体
2.动态过程捕获:蛋白质折叠中间态捕获效率提升80%
3.临床诊断应用:血液样本直接上样,省去超速离心步骤
四、技术发展前瞻
通过整合微流控芯片与自动移液系统,该技术正在向高通量冷冻电镜平台演进。最新研究显示(Nature Methods, 2023),结合AI算法的亲和层设计可将靶标捕获特异性提升至99.2%。
参考文献:1.Yu, G.; Li, K.; Jiang, W., Antibody-based affinity cryo-EM grid. Methods 2016, 100, 16-24.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,提供材料测试、高端测试、环境检测、生物服务、模拟计算、科研绘图、数据分析、试剂耗材、行业解决方案、指南针学院等多项科研产品和服务矩阵。企业致力于为高校、科研院所、医院、研发型企业等科研工作者,提供专业、快捷、全方位的检测及科研服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-05-14
2025-05-14
 2460
2460
 0
0










