【摘要】 (l)Ni电极在1 mol/L的KOH溶液中的循环伏安特性。
黄可龙等[1]采用循环伏安法对LiFePO4 在水溶液中的电化学行为进行了研究,结果表明,LiFePO4 在饱和LiNO3 溶液中具有良好的电化学可逆性。
下面以Ni在碱液和酸性溶液中的CV行为为例具体介绍循环伏安法在测定电极反应方面的实际应用。
(l)Ni电极在1 mol/L的KOH溶液中的循环伏安特性。
为了去除表面的氧化物,将Ni单品在纯氢气流(1个大气压)的保护下,于1200K退
火3- 10 h。比用0.05 µm的氧化铝细细抛光经清洗干净,在0.5 mol/LH2SO4溶液中阴极极化数分钟,极化电流以电极表面有大量气泡逸出为宜。取出冲洗干净,再放入电解池 (l mol/L KOH溶液)控制电极电势为-0.2V进行阴极还原数分钟。这样即可得到光亮新鲜的Ni电极表面。
Ni(111)电极在l mol/L KOH溶液中的CV曲线见图1。根据其CV特性,通常可将CV曲线分为三个区域。A区为“Ni(OH)2 区” 或称“Ni(II) 区”,在比A区电势更负的电势下,将有氢气析出,且有一部分氢被Ni的晶格吸收。在A区的正向扫描过程出现的电流峰a,对应α-Ni(OH) 2 的生成,并伴随有体相吸收(或吸附)氢的逸出及氧化。
Ni+ 2OH-⇒Ni(OH) 2 + 2e
Hads+abs ⇒H++e-
注:Hads 指吸附于表面的H原子,Habs 指被金属吸收的H,这部分H会进入金属内部。
负向扫描过程中的峰a'为α-Ni(OH)2还原成金属Ni。α-Ni(OH)2 经过不可逆缩水可
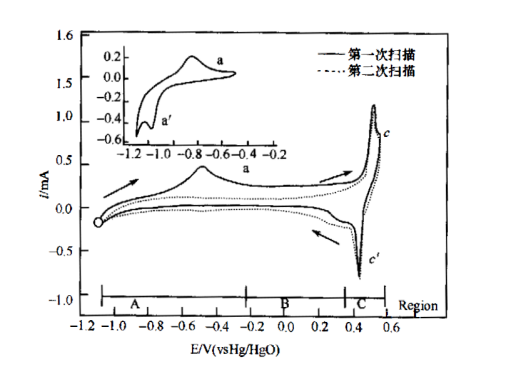
图1 Ni(111)电极在KOH溶液中的循环伏安图,扫描速率:50 mV/s,
嵌入图扫描速率为l0 mV/s
转变为β-Ni(OH)2,这一不可逆转变过程发生在B区。随着电势进入B区,峰a和峰a'将逐渐减弱甚至完全消失,这是因为形成的β-Ni(OH)2在接下来的阴极扫描过程中不能被还原。C区称为"NiOOH区”或"Ni(Ⅲ)区”,该区对应的电势足够正,可使之前的Ni(OH)2发生氧化。在CV图上观察到的较大的阳极电流峰c与氧化物的形成以及Ni的氧化态从+2价变到+3价有关,如果发生过充的话,还可能达到更高的价态。
Ni(OH)2 ⇒NiOOH+ H++ e-
该反应中生成的H+在碱液中即形成了H2O。
参考文献
[1] 黄可龙, 杨赛, 刘素琴,等. 磷酸铁锂在水溶液中的循环伏安研究[J]. 电源技术, 2007, 131(5):386-388.
[2]《电化学测定方法》藤岛昭等著,陈震等译
[3]《电化学测量》胡会利
科学指南针为超过3000家高校和企业提供一站式科研服务。截止2021年6月:服务1049家高校、2388家企业,提供249所高校研究所免费上门取样服务,平均每天处理样品数5000+、 注册会员数18w+、平均4.5天出结果、客户满意度超过98%。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2022-02-28
2022-02-28
 4447
4447
 0
0










