【摘要】 为了解决这个问题,Xiaoling Ren等人[1]的工作中报道了通过使用小鼠结肠癌细胞膜(CT26CCM)来伪装Bi-NP(大小:~42±2 nm)。
Bi纳米粒子(NP)已被证明是一种有效的一体化治疗剂,可用于图像引导的光热治疗,但其应用受到相对较低的生物相容性和靶向积聚能力的限制。为了解决这个问题,Xiaoling Ren等人[1]的工作中报道了通过使用小鼠结肠癌细胞膜(CT26CCM)来伪装Bi-NP(大小:~42±2 nm)。其治疗方案如图1所示。
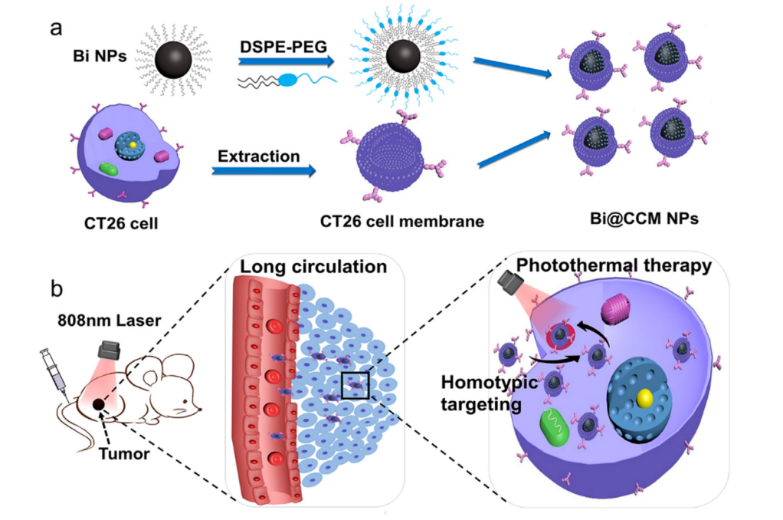
图1用于增强光热治疗的Bi@CCM NPs示意图(a) Bi@CCM NPs的编制程序(b) Bi@CCM NPs具有更好的循环时间和肿瘤PTT的同型靶向能力的示意图
通过TEM图像、ζ电位和蛋白质凝胶电泳测试可以证实,伪装过程在Bi-NPs核上赋予了厚度为~8±2nm的CCM壳层的有效涂层。同时,CCM壳层对光吸收/光热效应没有副作用。重要的是Bi@CCM纳米颗粒保留了CCM的显著特征,包括良好的生物相容性和同源靶向能力。
为了进一步生动地评价光热治疗效果,将CT26细胞分为生理盐水(I)、NIR(II)、,Bi@CCM三、Bi@CCM+NIR(IV)组。将组(I,II)中的CT26细胞与RPMI-1640培养基一起孵育Bi@CCMNP,而组(III,IV)中的CT26细胞与含有Bi@C CMNP。在组(II,IV)中,将细胞连续暴露于808nm激光(1.0 W cm-2)下10分钟。之后,用Calcein AM(绿色发光显示活细胞)和碘化丙啶(PI,红色发光显示死细胞)对CT26细胞进行共染色。
显然,组(I-III)中的CT26细胞显示出绿色荧光,表明存在活细胞(图2)。这些事实表明,激光或Bi@CCM单独对CT26细胞没有任何治疗作用。相反,第四组(Bi@CCM+NIR)显示几乎全红色发光,证实几乎所有细胞都死亡。上述事实证实Bi@CCM近红外激光对癌症细胞具有良好的光热治疗效果。经808nm激光照射后,经高积累的CT26癌症细胞的光热治疗,可有效消融细胞Bi@CCMNP,然后肿瘤往往在12天后被根除。
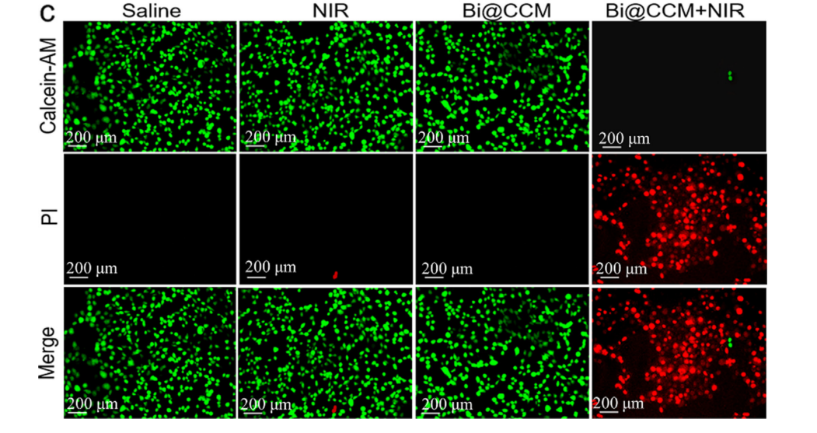
图2 808 nm激光照射后Calcein AM/PI染色CT26细胞的荧光图像
同时,CCM壳层对光吸收/光热效应没有副作用。重要的是Bi@CCM纳米颗粒保留了CCM的显著特征,包括良好的生物相容性和同源靶向能力。CCM伪装的聚乙二醇化Bi纳米粒子(NPs)。CCM伪装后,Bi@CCM与未涂覆的Bi-NPs的血液循环半衰期(血液中4.0小时和肿瘤中2.03±0.60%ID/g)相比,在同型CT26肿瘤中表现出更高的血液循环寿命(11.5小时,2.9倍)和积聚量(4.7±0.56%ID/g,~2.3倍)。
重要的是,高积累的光热效应可以有效地摧毁CT26肿瘤Bi@CCMNP,然后在治疗后有效地消除肿瘤。因此Bi@CCM纳米颗粒可以作为一种有前途的光热纳米制剂有效治疗同源肿瘤。因此,用CT26 CCM伪装的Bi-NPs在靶向光热治疗同种型肿瘤方面具有巨大潜力。
[1] Xiaoling Ren, Shuangping Yang, Nuo Yu, Ahmed Sharjeel, Qin Jiang, Daniel K. Macharia, Han Yan, Changrui Lu, Peng Geng, Zhigang Chen, Cell membrane camouflaged bismuth nanoparticles for targeted photothermal therapy of homotypic tumors, Journal of Colloid and Interface Science, Volume 591, 2021, Pages 229-238.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,并荣获国家高新技术企业、国家“互联网+科研服务领军企业等多项荣誉。未来,科学指南针将继续朝着“世界级科研服务机构”的目标,在产品研发和用户服务等方面持续努力,为科学发展和技术创新做出更大贡献。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-08-02
2024-08-02
 2878
2878
 0
0










