【摘要】 Yan等人报道了用两亲性药物-药物偶联物(ADDC)构建的无载体Ir–Cb纳米颗粒。
癌症的发病率是导致死亡的主要原因之一,是一个严重的公共卫生问题。到目前为止,化疗是癌症的主要治疗策略。然而,化疗本身在临床实践中有许多缺点,如疗效差、全身毒性和耐药性。为了解决这些问题,人们对构建能够共同递送两种或多种治疗剂的协同药物递送系统产生了极大的兴趣,以实现对抗肿瘤异质性的协同治疗效果。这些策略不仅可以利用不同的治疗方法显著增强抗肿瘤效果,还可以克服严重的不良反应。近年来,化疗与光热疗法的结合在癌症治疗领域引起了极大的关注。光热疗法(PTT)使用近红外(NIR)光热光剂吸收光能,可能导致不可逆的肿瘤损伤。作为一种有前景的癌症侵袭性治疗策略,热疗还可以通过增加细胞膜的通透性来提高肿瘤细胞对抗肿瘤药物的摄取,并提高细胞对化疗的敏感性。为了实现这一点,已经构建了许多纳米级药物递送系统,用于协同癌症治疗的光热剂和化疗剂的共同递送。尽管这些药物递送系统的协同作用已被许多研究证明,但它们在更广泛的应用中仍面临许多限制。
Yan等人[1]报道了用两亲性药物-药物偶联物(ADDC)构建的无载体Ir–Cb纳米颗粒。在被肿瘤细胞吸收后,无载体的Ir–Cb纳米颗粒可以释放游离的Ir和Cb,从而提高癌症的治疗效果。尽管两亲性小分子前药令人感兴趣,但它们仍然存在许多缺点。这些两亲性药物-药物偶联物大多是通过酯键构建的,在细胞内化之前,酯键也可以在细胞外肿瘤组织中裂解,导致抗癌功效降低。此外,酯键是一种相当稳定的键,这将导致药物在细胞内环境中缓慢释放,并降低细胞毒性。
使用氧化还原响应性二硫键将疏水性药物CPT与亲水性光热剂IR820连接起来,形成一种新的前药两亲物,命名为IR820-SS-CPT(图1)。构建的IR820-SS-CPT具有几个突出的优点。首先,由于其两亲性,IR820-SS-CPT可以在水溶液中自组装成纳米颗粒(称为IR820SS-CPT NPs),而无需任何其他载体的帮助。

图1 用于化学光热治疗的氧化还原反应性IR820-SS-CPT NP的说明。IR820-SS-CPT NP通过疏水和π–π堆叠相互作用的自组装示意图。B推测的通过GSH处理从IR820-SS-CPT NP释放CPT的机制。C拟建IR820-SS-CPT NPs的优势
通过四步工艺合成了治疗前药IR820-SS-CPT,如图2所示。首先,在三光气存在下,通过CPT与2-羟乙基二硫化物反应制备CPT-S-OH。接下来,Mendoza等人[2]在CPT-SS-OH和氯甲酸4-硝基苯基之间的反应得到羟基活化的酯CPT-SS-LG。然后,通过IR820与1,6-己二胺的反应获得关键中间体IR820-NH2。最后,IR820NH2与CPT-SS-LG反应得到IR820-SS-CPT。通过1H NMR、13C NMR和ESI–MS对IR820-SS-CPT的化学结构进行了表征。附加文件1:图S7显示了产物IR820-SS-CPT的1H NMR光谱。的特征峰值在2.16(td,J=7.214.3Hz,2H)和0.91(t,J=7.3Hz,3H)ppm处发现CPT内酯环上的乙基。同时,IR820的四个甲基的特征峰出现在1.92–1.85(m,12H)ppm处。
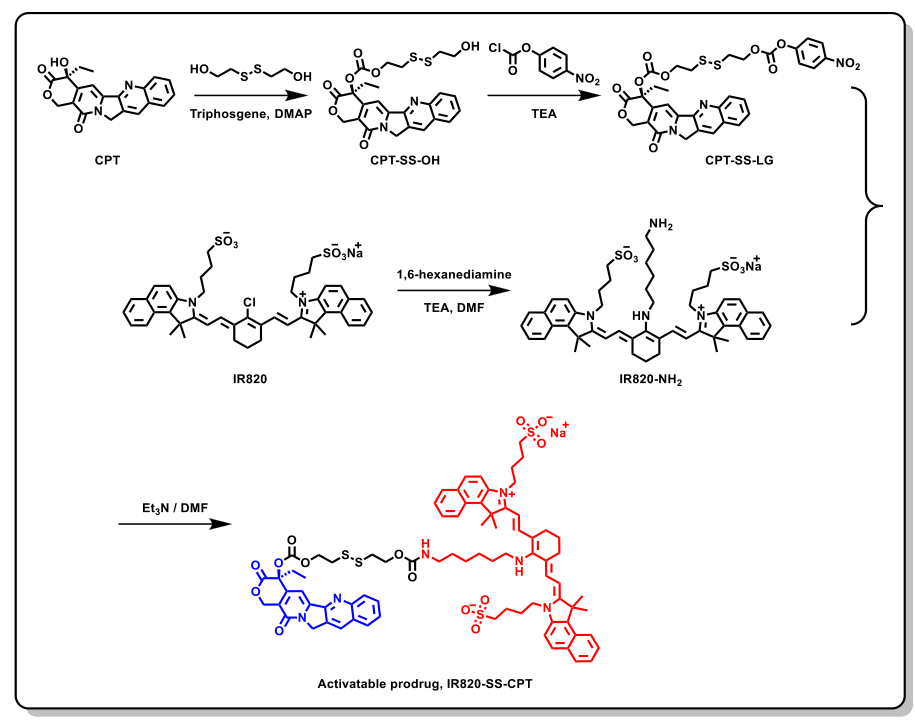
图2 IR820-SS-CPT的合成路线
[1] Huang P , Wang D, Su Y, Huang W, Zhou Y, Cui D, Zhu X, Yan D. Combination of small molecule prodrug and nanodrug delivery: amphiphilic drug–drug conjugate for cancer therapy. J Am Chem Soc. 2014;136(33):11748–56.
[2] Mendoza G, Ortiz de Solorzano I, Pintre I, Garcia-Salinas S, Sebastian V, Andreu V, Gimeno M, Arruebo M. Near infrared dye-labelled polymeric micro- and nanomaterials: in vivo imaging and evaluation of their local persistence. Nanoscale. 2018;10(6):2970–82.











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-08-05
2024-08-05
 2958
2958
 0
0










