【摘要】 循环伏安法(CV)是电化学研究中的重要技术,用于分析电极反应的性质、机理和动力学参数。
科学指南针-知识课堂
循环伏安法(CV)是一种电化学分析技术,通过控制电极电势以三角波形周期性扫描,记录电流-电势曲线,以研究电极反应的可逆性、中间体、相界吸附、新相形成和耦联化学反应。它用于测量反应参数、判断控制步骤和机理,观察电势范围内的反应性质。电活性物质的可逆性差会导致氧化波和还原波高度和对称性不同。CV的电压扫描速度可调。
循环伏安法(CV)
循环伏安法(CV)是电化学研究中的重要技术,用于分析电极反应的性质、机理和动力学参数。其要点包括:
要点一:
电极可逆性判断:通过循环伏安图的氧化波和还原波的峰高和对称性,可判断电活性物质在电极表面的可逆性。对称的曲线指示可逆反应,不对称的曲线指示不可逆反应。
要点二:
电极反应机理研究:CV可探究电极吸附现象、电化学反应产物及电化学-化学偶联反应。
用途:
-
判断电极表面微观反应过程。
-
确定无机和有机合成的最佳条件。
-
分析前置(CE)和后置(EC)化学反应的特征。
-
评估催化反应的特性。
循环伏安曲线分析
分析一:
阮艳丽的研究通过循环伏安法比较了不同锂源(碳酸锂Li2CO3、氢氧化锂LiOH·H2O、乙酸锂LiCH3COO)合成的磷酸铁锂样品的电化学性能。
结果显示:
-
所有样品的循环伏安曲线均显示一对氧化还原峰,代表锂离子的脱嵌过程。
-
氧化还原峰间的电势差越小,反应可逆性越高。
-
Li2CO3合成样品的电势差为0.334V,LiOH·H2O为0.379V,LiCH3COO为0.556V,表明Li2CO3合成样品具有最高可逆性。
-
LiCH3COO合成样品的氧化峰与还原峰不对称,且氧化峰处有肩峰,暗示锂离子扩散不畅。
循环伏安曲线表明,Li2CO3合成的磷酸铁锂具有良好的充放电循环性能。

图1-图片源自网络
图1(用不同锂源合成的磷酸铁锂材料的循环伏安曲线)
分析二:
郅晓科研究的磷酸铁锂样品循环伏安曲线:
结果显示:
-
锂离子嵌入脱出过程对应尖峰。
-
峰形对称,氧化还原峰面积相等,显示高可逆性。
-
扫描速率增加导致电流峰增大,峰值电压间距扩大,暗示锂离子扩散受限。
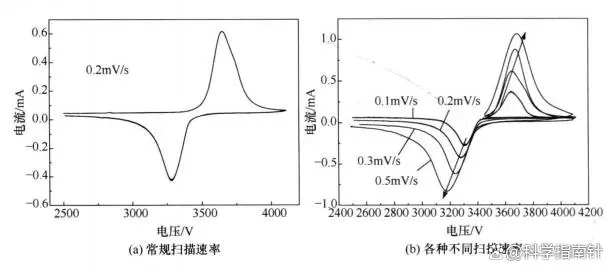
图2-图片源自网络
图2(磷酸铁锂样品的循环伏安曲线)
LiFePO4/C样品(10%碳含量)的循环伏安曲线显示:
-
强氧化还原峰表明有效的锂离子反应。
-
初始电位差0.36V,第二次循环减小,显示提高的可逆性。
-
第二至第五循环曲线稳定,证明循环稳定性。
-
尽管有电位差,材料仍展现良好动力学特性。
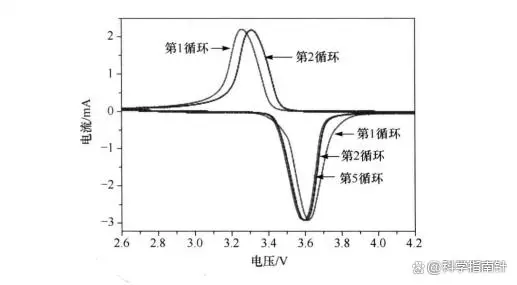
图3-图片源自网络
图3(10%碳含量的LiFePO4/C样品的循环伏安曲线)

新能源电池材料测试
免责声明:部分资料来源于网络,如有侵权麻烦请联系我们











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-08-23
2024-08-23
 5924
5924
 0
0










