【摘要】 在这种结构中,氧原子占据面心立方的32e位置,锰原子则位于16d位置,形成八面体结构。锂离子则填充在8a位置的四面体空隙中。
科学指南针-知识课堂

图片源自网络
尖晶石结构的LiMn2O4物质,其晶体结构属于Fd3m空间群,具有氧原子以立方密堆积的方式排列。在这种结构中,氧原子占据面心立方的32e位置,锰原子则位于16d位置,形成八面体结构。锂离子则填充在8a位置的四面体空隙中。
这种结构中,空置的四面体和八面体通过共享面和边相互连接,构建了锂离子在三维空间内扩散的通道。锂离子的扩散系数通常在\[10^{-14}\]至\[10^{-12}\]平方厘米每秒之间。尖晶石型LiMn2O4的理论比容量为148毫安时每克,而在实际应用中,比容量大约为120毫安时每克。
LiMn2O4制备方法

图片源自网络
固相合成法在制备材料时存在几个问题,这些问题包括物相的不均匀性、晶粒的不规则形状和较大的晶界尺寸,以及宽泛的粒度分布。此外,固相合成法的煅烧时间较长,这可能会影响生产效率。
为了解决这些问题,可以采用熔融浸渍法。这种方法使用熔点较低的锂盐作为前驱体,例如LiOH或LiF,与锰的氧化物进行反应。在加热至锂盐的熔点时,锂盐能够充分渗入锰氧化物的微孔中,这一过程在600至700摄氏度下进行。

图片源自网络
熔融浸渍法通过增加原料间的接触面积,改善了原料混合的不均匀性,从而加速了固相反应。这种方法的结果是,初始可逆容量得到了提高,达到了120至130毫安时每克。通过这种方式,可以更有效地制备具有更优性能的材料。
LiMn2O4容量衰减原因分析
LiMn2O4正极材料在循环时,尤其在高温条件下循环时(55℃),存在着容量衰减问题,导致循环性能变差。
原因①:锰的溶解
放电末期Mn3+的浓度最高,在粒子表面的Mn3+发生歧化反应:
2Mn3+(固)→Mn4+(固)+Mn2+(溶液)
歧化反应产生的Mn2+溶于电解液中,一方面是LiPF6与痕量水反应生成的HF酸,加速Mn的溶解;因此,Mn的溶解是LiMn2O4容量损失的主要原因。
原因②:Jahn-Teller效应
杨-泰勒效应是一种分子几何构型变化的现象,它发生在电子在简并轨道中的不对称占据时。这种不对称占据会导致分子的几何构型发生畸变,从而降低分子的对称性,减少轨道的简并度,进而使整个分子体系的能量降低。
简单来说,杨-泰勒效应描述了对称性非线性分子在简并状态下不可能保持稳定,系统会通过畸变来降低某个轨道的能量,以消除简并性,从而达到更稳定的状态。
在某些化学反应过程中,特别是在放电末期,杨-泰勒效应可以在粒子表面首先发生,随后这种畸变会扩散到整个反应组分中。例如,在某些材料的相变过程中,如立方相向四方相的转变,就是杨-泰勒效应的一个具体体现。这种结构转变通常伴随着能量的降低,是系统趋向于更稳定状态的表现。
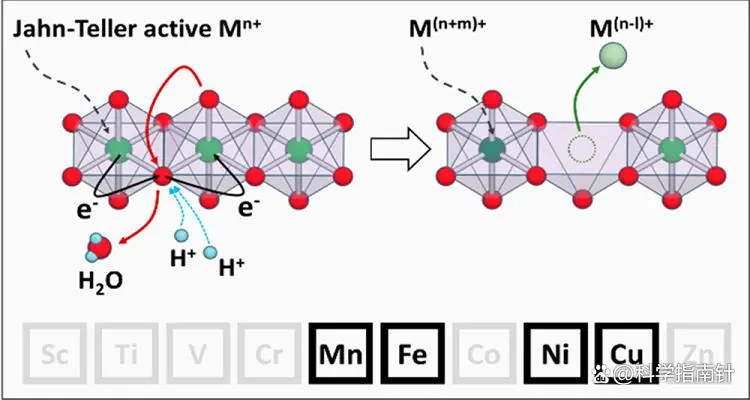
图片源自网络
原因③:Mn的高氧化性
在有机溶剂中,高度脱锂的尖晶石性Li1-xMn2O4,在充电尽头不稳定,即Mn4+的高氧化性。
尖晶石LiMn2O4材料的改性:
-
减少尖晶石的比表面积(电解液、催化分解和Mn的溶解速率)
-
在电解液中加入添加剂(如沸石,↓H+含量,抑制副反应发生)
-
掺杂阳离子(如Li、B、Mg、Al、Ti、Cr、Fe、Co、Ni、Cu等)
-
掺杂阴离子(如O、F、I、S、Se等)
-
表面处理
(a)用有机物进行表面处理(如乙酰丙酮、导电性聚吡咯、聚噻吩等)
(b)无机氧化物进行表面包覆(如氧化硼锂(LiBO2)、Li2CO3、MgO、SiO2、ZnO、氧化钴锂等)

新能源电池材料测试
免责声明:部分资料来源于网络,如有侵权麻烦请联系我们











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-06-19
2024-06-19
 6576
6576
 0
0










