【摘要】 在透射电镜下,自噬体清晰可见为两个由电子半透明孔隔开的膜双层。
自噬是真核生物高度保守的大分子降解途径[1]。在植物中,自噬是由几种胁迫条件诱导的,包括饥饿、氧化胁迫、盐胁迫和衰老[2]。在自噬过程中,称为自噬体的双膜囊泡在细胞质中形成并运输到中央液泡,在那里自噬体的外膜与液泡膜融合。然后称为自噬体的单膜结构进入液泡腔并最终被降解。
迄今为止,已经建立了许多检测植物自噬的方法。常用的检测方法有共聚焦显微镜、电子显微镜和生化法。共聚焦显微镜检测采用与荧光蛋白融合的自噬标志物ATG8、ATG5、SH3P2标记自噬相关结构。[3, 4]此外,荧光嗜酸染料如单胺尸胺(MDC)也被用于标记植物细胞中的自噬结构。测定自噬通量的生化方法是检测ATG8与ATG8- pe的比值,或GFPATG8与GFP的比值。然而,TEM因其高分辨率而在这些方法中显着突出,从而提供了更清晰的自噬结构及其货物信息。因此,通过透射电镜观察,可以对自噬进行定性和定量分析。在透射电镜下,自噬体清晰可见为两个由电子半透明孔隔开的膜双层。同时,它含有降解的货物。一般来说,在非选择性自噬过程中,自噬结构的大小为0.5 ~ 1.5 μm。
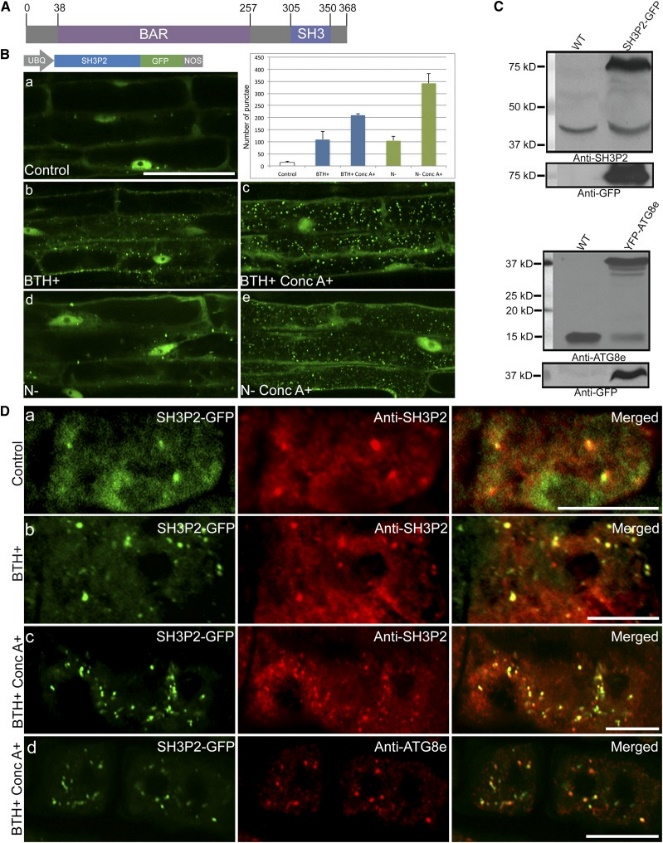
图1 SH3P2-GFP响应自噬诱导。[3]
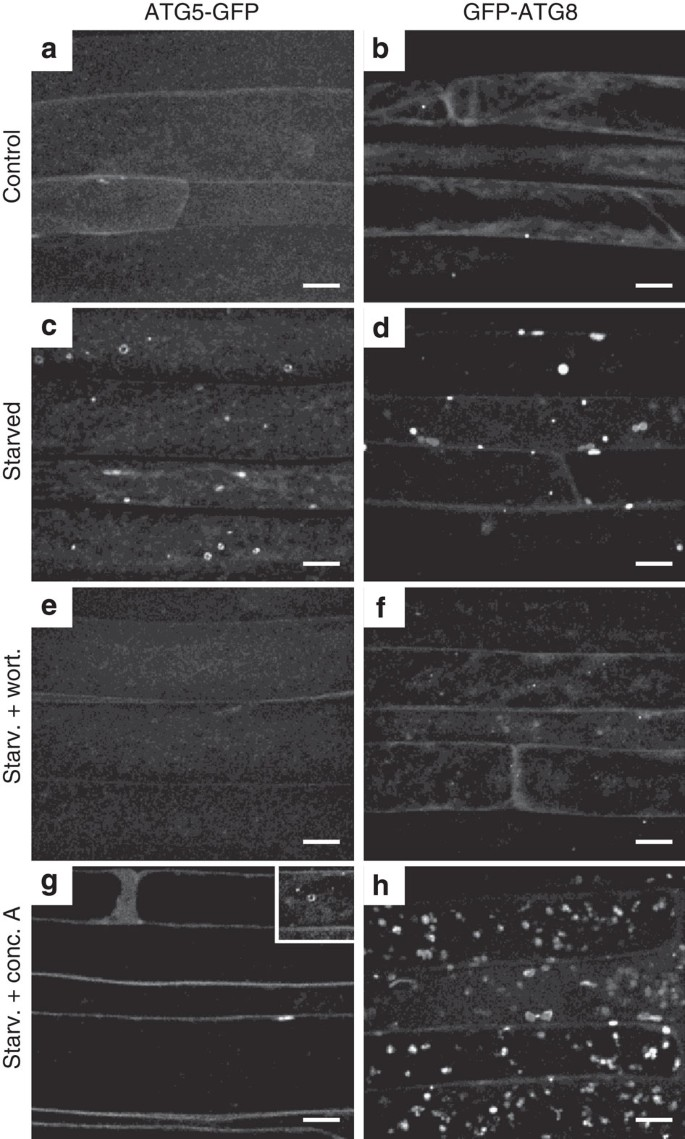
图2 ATG5-GFP亚细胞模式自噬诱导。[4]
对于选择性自噬,自噬结构的大小取决于特定的底物。Zheng等人[5]描述了用透射电镜检测GAPC沉默植物细胞自噬活性的方案。在25°C的生长室内,在16小时的光照/8小时的黑暗周期下,烟叶植物生长4周。将含有pTRV1和pTRV2的农杆菌菌株GV3010或其衍生物GAPCs或GAPCs/ATG3共沉默构建物按1:1的比例混合,渗透到植物的顶部两片叶片中,分别沉默植物中的GAPCs和GAPCs/ATG3。当目标基因在浸润后16-18天(dpi)沉默成功时,将20 μΜ E-64d渗透到基因沉默成功的两片新叶中。E-64d处理8-12小时后,将处理过的叶片切成小片(1mm × 1mm)。将小片叶片用300 μl多聚甲醛-戊二醛固定液(2%/2.5%,pH 7.2)固定于1.5 ml管中。使用隔膜真空泵在0.1 MPa下抽真空10-30分钟,直到碎片沉入管的底部。用牙签戳这些碎片,帮助它们沉到管子的底部。用多聚甲醛-戊二醛固定液(2% /2.5%,pH 7.2)在冰上固定1小时。
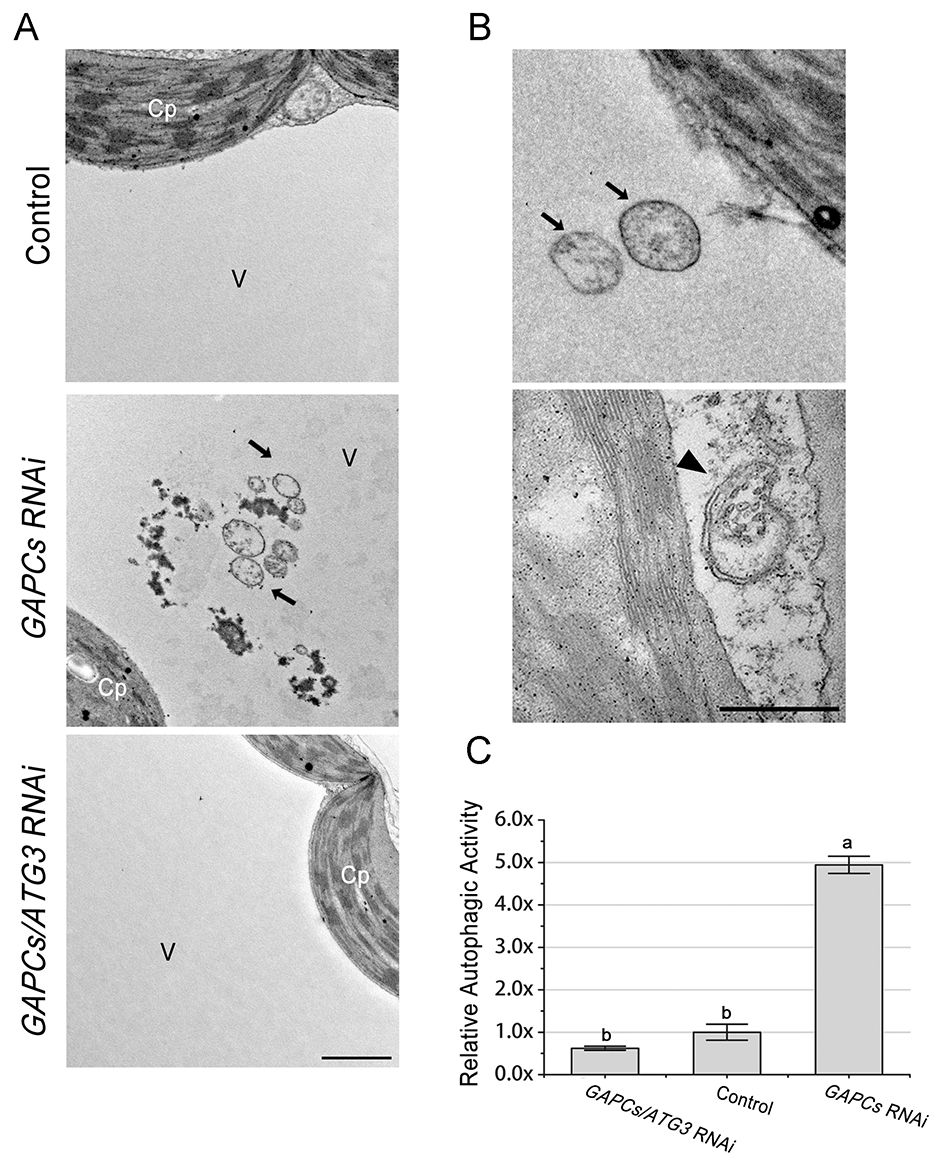
图3 对照和VIGS植物自噬样结构的透射电镜检测。
用0.1 M PBS缓冲液在摇床中洗涤3次,每次15分钟(应在摇床中完成)。用oso4 -六氰亚铁酸盐固定液(1%/1.5%)在冰上固定1h。用0.1 M PBS缓冲液室温(RT)洗涤3次,每次15分钟。用ddH2O在室温下洗涤3次,每次10分钟。在室温下,用1%醋酸铀酰在暗处染色1小时。用ddH2O在室温下洗涤3次,每次15分钟。在30%、50%、70%、80%、90%和95% (v/v)的乙醇梯度系列中脱水,每次10分钟。用100%乙醇脱水3次,每次10分钟。100%环氧丙烷脱水2次,每次10分钟。在室温下,将样品与环氧丙烷:epon 812按2:1的体积比例在摇床中孵育30分钟。在室温下,将样品与环氧丙烷:epon 812按2:1的体积比例在摇床中孵育30分钟。用epon 812在摇床中孵育样品过夜。epon 812刷新3次,每次3小时。用epon 812将样品埋入40孔平板埋入模中。用epon 812在37℃下渗透样品4小时。树脂在60°C下,24-48小时。用美工刀将嵌块切割至能锯出样品为止。继续用玻璃刀切割样品,直至表面光滑。用美工刀将样品表面切成梯形。用金刚石刀在超微切片机上将嵌入块切成70纳米的超薄切片。用睫毛笔在涂有formvar涂层的网格上收集它们。用染色机用2%醋酸铀酰染色30分钟,0.2%醋酸铅染色5分钟。在电子显微镜下检查切片。观察叶肉细胞的自噬结构,记录自噬结构数目和细胞数目。
[1]. Dikic, I., Proteasomal and Autophagic Degradation Systems. Annu Rev Biochem 2017, 86, 193-224.
[2]. Doelling, J. H.; Walker, J. M.; Friedman, E. M.; Thompson, A. R.; Vierstra, R. D., The APG8/12-activating enzyme APG7 is required for proper nutrient recycling and senescence in Arabidopsis thaliana. J Biol Chem 2002, 277 (36), 33105-14.
[3]. Zhuang, X.; Wang, H.; Lam, S. K.; Gao, C.; Wang, X.; Cai, Y.; Jiang, L., A BAR-domain protein SH3P2, which binds to phosphatidylinositol 3-phosphate and ATG8, regulates autophagosome formation in Arabidopsis. Plant Cell 2013, 25 (11), 4596-615.
[4]. Le Bars, R.; Marion, J.; Le Borgne, R.; Satiat-Jeunemaitre, B.; Bianchi, M. W., ATG5 defines a phagophore domain connected to the endoplasmic reticulum during autophagosome formation in plants. Nat Commun 2014, 5, 4121.
[5]. Zheng, X.; Zhao, C.; Liu, Y., Examining Autophagy in Plant by Transmission Electron Microscopy (TEM). Bio-protocol 2018, 8 (20), e3047.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,并荣获国家高新技术企业、国家“互联网+科研服务领军企业等多项荣誉。未来,科学指南针将继续朝着“世界级科研服务机构”的目标,在产品研发和用户服务等方面持续努力,为科学发展和技术创新做出更大贡献。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-08-19
2024-08-19
 5482
5482
 0
0










