【摘要】 本文详细介绍了生物透射电子显微镜的六步制样流程,包括取材、固定、脱水、包埋、超薄切片和电子染色,强调关键操作要点如快速取材、双固定法、梯度脱水等,并提供了实用注意事项,适用于生物学研究中的细胞超微结构观测和病毒颗粒分析。

生物透射电子显微镜是生物学研究中的重要工具,它能够提供高分辨率成像,用于观测细胞超微结构、病毒颗粒、生物大分子结构等,并可通过冷冻技术实现生物体系中的动态观察,对多个生物学领域的研究具有重要作用。
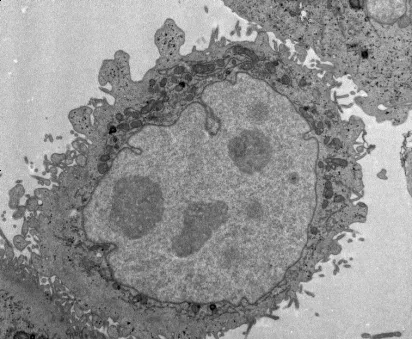
对于常规生物电镜制样流程,我们可以将其6步:取材→固定→脱水→包埋(渗透、包埋、聚合)→超薄切片→电子染色,下面我们将对各部分内容的重要点进行简单介绍。
1、取材
取材要点可以归结为快、小、冷、准以及避免机械损伤。其中,快指的是取材后尽快放入固定液避免结构变化;小指的是取材组织体积小,因为固定液渗透能力有限取材过大则无法充分固定;冷是指低温操作,相关物品均需预冷;准指的是取材位置准确;另外,取材过程避免对组织进行挤压等损伤行为。
2、固定
固定是为了保护相关结构在后续操作中避免破坏,呈现出材料最原始的形态。固定液由固定剂和缓冲液配置而成。缓冲液可以模仿细胞外液成分,维持稳定pH值和适当的渗透压。以下是几种常用的固定剂:
(1)戊二醛,最常用的固定剂,可以保护蛋白质和酶活性;无电子染色作用
(2)多聚甲醛,可以保存酶活性,常用于细胞化学
(3)锇酸,固定脂类、膜结构;有电子染色作用
一般,采用双固定法,首先用戊二醛进行前固定,漂洗后用锇酸进行后固定。
3、脱水
为了保证包埋剂可以完全渗入组织内部,需要进行完全脱水。常用的脱水剂是酒精、丙酮和环氧丙烷。脱水要彻底且脱水时间不宜过长,固定后的样品要进行充分漂洗。通常使用逐级梯度脱水,如依次浸泡酒精浓度为30%、50%、70%、80%、90%、100%,一般浸泡时间为10-20 min左右,最后可以用100%丙酮浸泡。(当然,此方法及浓度并非绝对,需要根据材料进行合理的安排~)
4、包埋
包埋主要三个过程,渗透、包埋和聚合。需要注意以下几点:
(1)在配制包埋剂时,应该软硬度易调节,易于渗透
(2)包埋时要防止产生气泡
(3)聚合时的温度要尽可能低
5、超薄切片
切片的流程大体为装块、装刀、对刀、加水、切片、捞片。常用玻璃刀或钻石刀,刀上需要装水槽并注入新鲜槽液,而且需要密封防止漏水,常用的槽液有二甲基亚砜(DMSO)、甘油水溶液等。
注意事项:
(1)使用新鲜槽液,槽液不与材料发生反应,液面与刀口基本平行
(2)刀槽密封避免漏水
(3)保持适宜的温度和湿度,一般分别为25℃左右和60℃左右
6、电子染色
超薄切片的染色就是利用重金属离子对不同细胞结构的结合能力不同,使得细胞内各结构对电子产生强散射能力从而增加发差。常用的染色液有铀盐和铅盐,为了得到最好的反差效果,用铀盐和铅盐复合使用,先染铀再染铅。常用染色剂主要是醋酸铀和柠檬酸铅,既可以单染也可以双染,双染色是最常用的方法。
(以上部分内容源于网络侵删)

如有生物实验相关问题
可添加管理员微信咨询











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-06-30
2025-06-30
 3346
3346
 0
0










