【摘要】 在众多可用的分析技术中,核磁共振波谱已被证明是研究血红蛋白最有价值的方法。
氢键(HB)在稳定许多有机分子和生物分子的三维结构中起着关键作用,在化学、生物学、药物设计等方面具有巨大的影响。氢键可以存在于与供体原子(D)和受体原子(s)共价结合的H原子(A)之间,其中D和A的电负性都应该大于H。根据受体原子的数量,HB可以是两中心的,也可以是三中心的(分叉)。分岔HB可以是(A/ H/A)型或(H/A/H)型。这些HBs可以是分子间的或分子内的,也可以是两种类型的混合物。分子间和/或分子内HB的存在可以控制各种天然和合成化合物的结构。选择性地引入HBs可能导致分子的理想构象任何HB的强度都与受体原子的电负性直接相关,也取决于几何参数,如H与受体原子之间的角度和距离。Surbhi Tiwari[1]等人通过取代竞争HB受体合成了一系列N-苯甲酰氰胺衍生物,并用核磁共振波谱和单晶XRD对其进行了研究。
在众多可用的分析技术中,核磁共振波谱已被证明是研究血红蛋白最有价值的方法。邻氨基苯甲酰胺类化合物具有重要的药理作用,广泛应用于抗菌、抗凝血剂,也是人类凝血因子的有效抑制剂。因此,通过苯甲酰环上的邻位取代反应,合成了一系列N-苯甲酰基邻氨基苯甲酰胺,其中存在一个H,一个供体(N)和两个H受体(O和X=F,OME),满足分子内HB分叉(三中心)的要求。所有这些分子都进行了表征,并通过核磁共振实验来确定是否存在HBs。
N-苯甲酰基邻氨基甲酰胺及其衍生物的结构框架以及HB中涉及的氢原子的编号;(B)可能形成分叉HB的图解。.png)
图1. (A)N-苯甲酰基邻氨基甲酰胺及其衍生物的结构框架以及HB中涉及的氢原子的编号;(B)可能形成分叉HB的图解。[1]
X-射线衍射仪是研究HB的另一种有效手段,键角D-H/A的线性关系即D-H…A 180°和更接近这个值证实了较强HB的存在。在1.2Å-1.5Å之间H与受主原子之间的距离也表明HB较强,而1.5-2.2Å的距离表明HB具有中等强度,而值>2.2Å建立了相对较弱的HB。分子2的X射线衍射结构如图2所示。NH1…F距离和N-H1…F角分别为2.310Å和110˚,对应于固体中的弱HB。
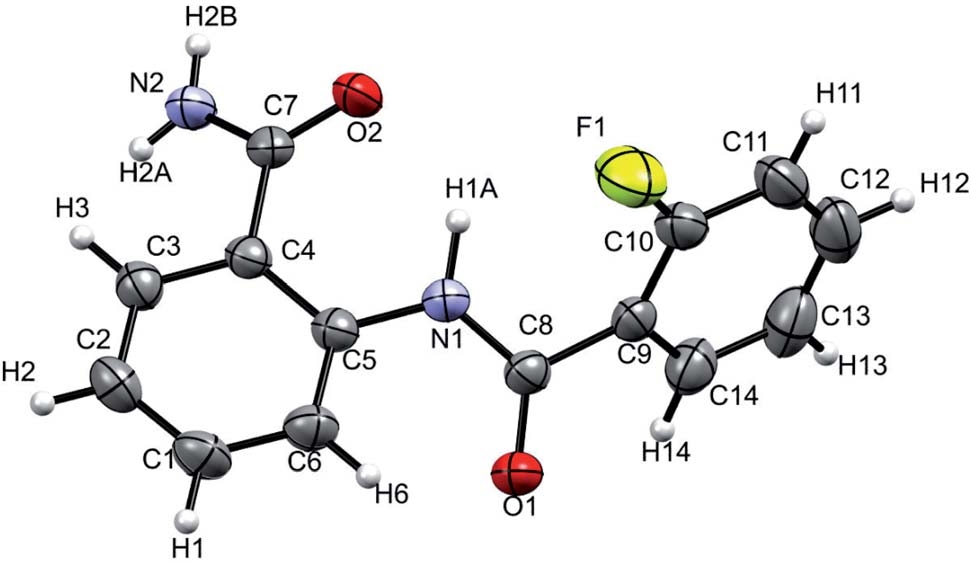
图2 分子2在298K的单晶X-射线衍射谱的50%几率能级。[1]
一维和二维核磁共振实验研究证实了N-苯甲酰基苯甲酰胺及其衍生物中存在弱的HB。2D NOESY(分子1)和2D HOESY(分子2)谱中的强关联峰确定了NH1和X(F或甲氧基)之间的空间接近,导致了HB的分叉存在。NH1质子的二重态为19F和NH1质子之间的HB提供了明确的证据。核磁共振实验结果得到了单晶X射线衍射和密度泛函理论计算的有力支持。
[1] S. Tiwari, N. Arya, S.K. Mishra, N. Suryaprakash, Competing HB acceptors: an extensive NMR investigations corroborated by single crystal XRD and DFT calculations, RSC Advances, 11 (2021) 15195-15202.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,并荣获国家高新技术企业、国家“互联网+科研服务领军企业等多项荣誉。未来,科学指南针将继续朝着“世界级科研服务机构”的目标,在产品研发和用户服务等方面持续努力,为科学发展和技术创新做出更大贡献。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-11-20
2024-11-20
 2776
2776
 0
0










