【摘要】 这些工具和其他一些工具已经成为实验结构确定方法的宝贵辅助手段,例如 X 射线结晶学,低温电子显微镜检查法(cryo-EM)和核磁共振波谱法,并且在药物发现中也发挥着越来越重要的作用。
深度学习是机器学习和人工智能(AI)的一个子领域,已经在许多学科中取得了令人印象深刻的进步,特别是计算机视觉和语言处理。由于深度学习的灵活性,它现在已经深深地嵌入到科学和日常生活的许多方面,包括高度复杂的大语言模型(LLMs) ,数字艺术和音乐的创造,以及从氨基酸序列中精确预测蛋白质结构
像许多科学分支一样,深度学习,无论是间接的还是直接的,已经彻底改变了生物分子核磁共振(nMR)光谱学领域。自上世纪40年代成立以来,核磁共振已经从最初在材料科学和化学领域的应用,发展成为环境分析、药物发现、大分子复合物角色塑造和人类代谢功能的通用工具。生物分子核磁共振波谱法是结构生物学的基石,为生物分子的相互作用和动力学提供了原子水平的见解。
AlphaFold26和 ESM-27等基于深度学习的结构预测因子已经证明了蛋白质结构测定的显着能力(图1A) ,为包括人类蛋白质组在内的整个蛋白质组提供免费可用的预测。这些工具和其他一些工具已经成为实验结构确定方法的宝贵辅助手段,例如 X 射线结晶学,低温电子显微镜检查法(cryo-EM)和核磁共振波谱法,并且在药物发现中也发挥着越来越重要的作用。
然而,重要的是要承认,虽然这些基于人工智能的工具非常有用,但它们在提供蛋白质生物学各个方面的见解方面确实存在一定的局限性,包括折叠机制,稳定性,翻译后修饰,突变和本质上无序的蛋白质(IDPs)。此外,这些软件工具在预测构象转换以及提供蛋白质功能动力学的详细理解方面的能力受到限制
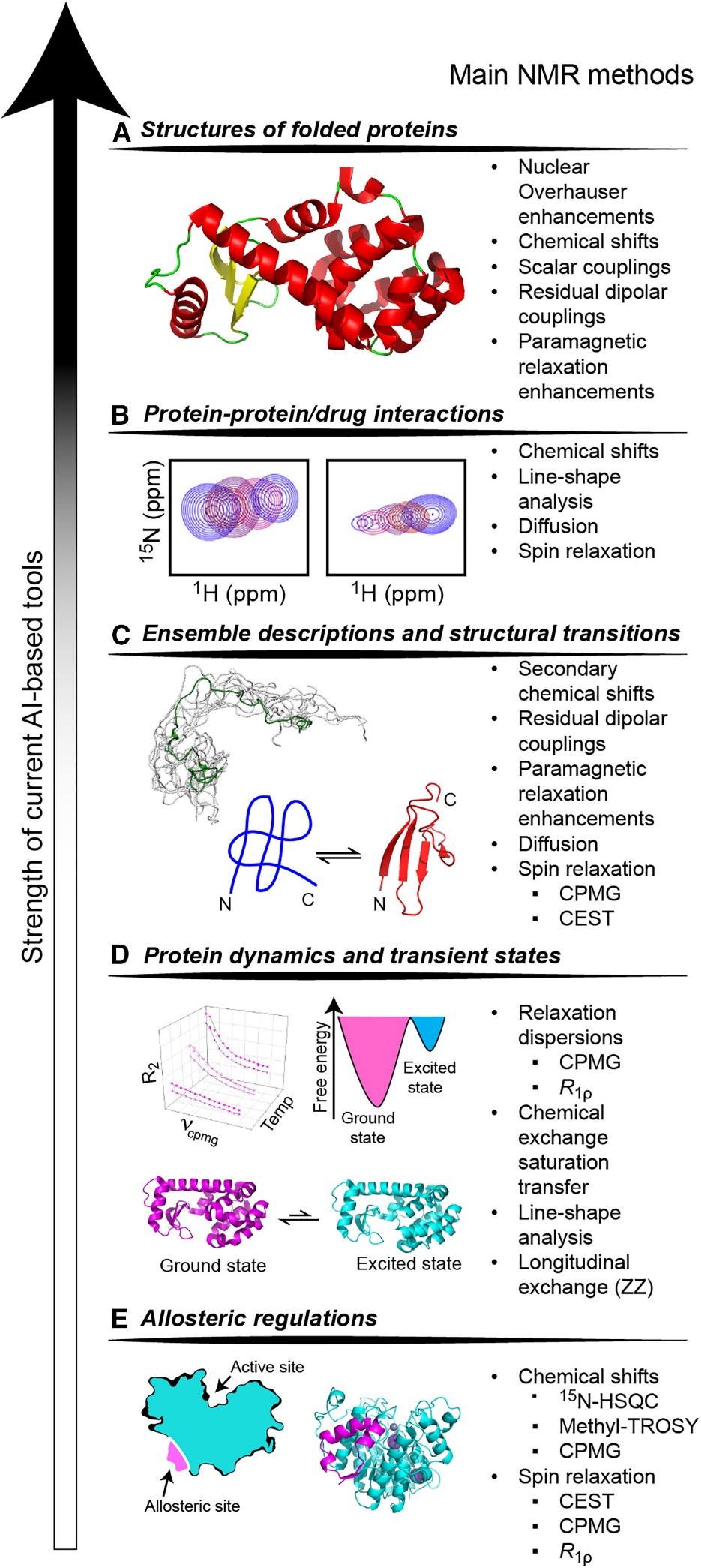
图1 阐述了基于人工智能的蛋白质结构和动力学特征以及核磁共振波谱法的高度互补性
AI 方法在预测小分子蛋白质结构(A)和偶尔预测蛋白质-配体相互作用(B)方面取得了显著的成功。然而,异质角色塑造的构象系综,例如 IDPs 和经历重大结构转变的蛋白质,对 AI 方法(C)提出了越来越大的挑战。此外,对于目前基于人工智能的方法来说,准确描述蛋白质动力学和瞬态状态(d)以及捕获别构调节(e)仍然非常困难。
为了应对这些挑战,我们强调核磁共振技术的应用,它提供了关于蛋白质构象、灵活性和相互作用的有价值的实验数据。通过结合 AI 和 NMR 的优势,可以更全面地了解蛋白质的结构和动力学,为结构生物学领域的新发现提供了潜力。
这些基于人工智能的工具的局限性突出了核磁共振作为直接解决这些关键知识差距的试验性工具的重要性。在这篇综述的前两部分,我们强调了生物分子核磁共振,特别是表征蛋白质动力学的溶液状态核磁共振方法,如何能够有效地填补我们理解中的这些空白,补充通过结构预测因子取得的实质性进展(图1)。在综述的最后一节中,我们强调了如何在溶液状态 NMR 的背景下直接利用深度学习来分析光谱,提高 NMR 测量的准确性和可靠性,简化与 NMR 实验相关的时间和费用,并能够开发以前无法实现的新型 NMR 实验(图2)。
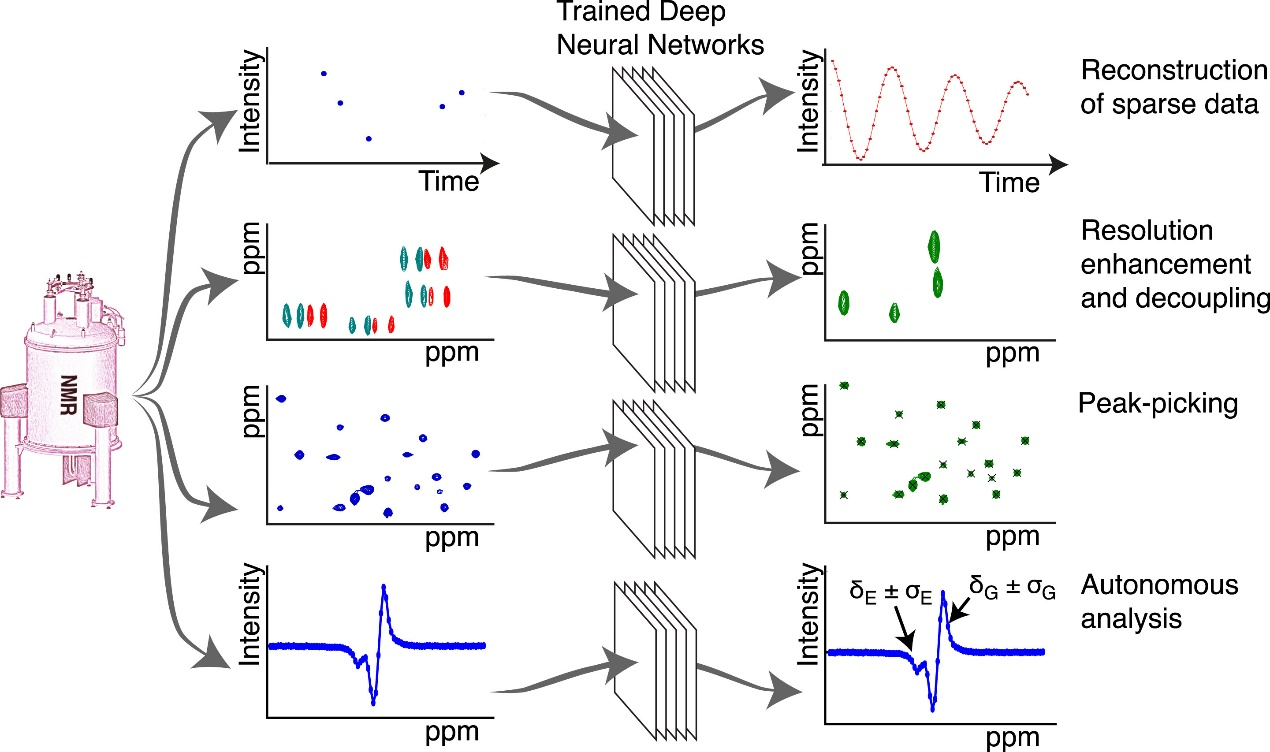
图2直接应用基于人工智能的方法来释放核磁共振波谱法的力量
说明 DNN 的变换能力,重建空间数据,提高分辨率和解耦光谱与虚拟同核解耦,挑选峰在拥挤的光谱,并执行自主分析。
核磁共振波谱法是建立在原子核与磁场相互作用的基础上的,它们提供了有关当地化学环境的有价值的信息。当受到外部磁场时,核自旋磁化以特定的频率(拉莫频率)共振,这受到诸如原子核的旋磁比、磁场强度和原子核附近的化学环境等因素的影响。
该化学位移与拉莫尔频率有关,是最容易测量的生物分子核磁共振参数,它提供了至关重要的生物化学见解。例如,骨架核化学位移的扰动可以表明结合相互作用或二级结构的变化(图1B)。通过空间相互作用可以通过使用核扩散效应(NOEs)来研究距离小于大约6 Å 或顺磁性松弛增强(PREs)的10至25 °C 之间的距离。
在高度精确的基于 AI 的蛋白质结构预测因子出现之前,基于核磁共振的结构测定提出了几个挑战。由此产生的光谱的复杂性和解释困难,加上所获得的参数作为结构信息报告者的间接性质,通常使得该过程具有挑战性和艰巨性,尽管已经尝试将该过程自动化。此外,基于 NMR 的结构测定方法主要适用于相对较小的蛋白质(< 40kDa)。尽管基于核磁共振的结构测定在一定程度上被 AI 蛋白质结构预测器、 X 射线结晶学和低温电磁波所掩盖,但核磁共振仍然在预测模型不足的地方提供了宝贵的见解,特别是在动力学、罕见折叠、配体结合和替代构象方面。
生物分子核磁共振通常仅被视为一种结构技术,然而,它也独特地能够用原子分辨率来表征许多时间尺度上的蛋白质动力学和灵活性(图1C 和1D)。例如,一些核磁共振方法,如经典的无模型分析能够研究皮秒(ps)到纳秒(ns)时间尺度上的运动。对于微秒到毫秒(ms)的运动,可以采用松弛分散测量,包括 R1ρ 实验、Carr-Purcell-Meiboom-Gill (CPMG)、化学交换饱和转移(CEST)或暗态交换饱和转移(DEST)。此外,较慢的运动可以用纵向交换方法来表征。
1.Vaibhav Kumar Shukla, Gabriella T. Heller, D. Flemming Hansen, Biomolecular NMR spectroscopy in the era of artificial intelligence, Structure, Volume 31, Issue 11, 2023, Pages 1360-1374, ISSN 0969-2126, https://doi.org/10.1016/j.str.2023.09.011.
科学指南针已获得检验检测机构资质认定证书(CMA)、实验动物使用许可证、“ISO三体系认证”等专业认证,并荣获国家高新技术企业、国家“互联网+科研服务领军企业等多项荣誉。未来,科学指南针将继续朝着“世界级科研服务机构”的目标,在产品研发和用户服务等方面持续努力,为科学发展和技术创新做出更大贡献。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2024-08-13
2024-08-13
 4532
4532
 0
0










