【摘要】 为了将用FIB-SEM获得的图像与传统TEM进行比较,在使用嵌入的动脉进行FIB-SEM检查之前,切割超薄切片(60nm)
高胆固醇血症和引发的炎症有助于斑块易发区域的动脉粥样硬化形成。降脂饮食和抗炎疗法会通过诱导平滑肌细胞的迁移和增殖并触发细胞外基质的合成来增厚纤维帽。
然而,随着炎症在斑块中持续存在,胶原基质会被降解,平滑肌细胞新的胶原合成会受到抑制,从而形成所谓的脆弱斑块。易损斑块是一种脂质填充的斑块,有一个薄的纤维帽;这些斑块容易破裂,并导致致命的急性血栓形成[1]。
为了进一步了解动脉粥样硬化形成过程中的(亚)细胞变化,从而了解动脉粥样硬化的发病机制,需要更详细地研究斑块和动脉健康区域的细胞结构。
为了能够导航到感兴趣的区域并随后放大到该区域以检测例如微小的形态学变化或特定细胞类型中蛋白质定位和/或表达的变化,高分辨率成像是必要的。
这限制了光学显微镜的使用,并且只能通过电子显微镜技术来实现。然而,传统的透射电子显微镜(TEM)不太适合定位生物样品中的感兴趣区域。
因此,在细胞研究中,通常使用相关显微镜以相对较低的放大率定位感兴趣的区域,并结合随后使用电子显微镜进行的高分辨率分析。
尽管已经优化了相关的显微镜方案[2],并且已经开发了新的探针,这些探针可以在荧光显微镜和电子显微镜中检测到,但这仍然是非常费力的。
此外,如果可能的话,获取三维(3D)信息将更加繁琐。因此,必须探索新的方法来满足这些需求。
为了将用FIB-SEM获得的图像与传统TEM进行比较,在使用嵌入的动脉进行FIB-SEM检查之前,切割超薄切片(60nm)(图1)。切片在含有雷诺铅的70%甲醇中的乙酸铀酰过饱和溶液中染色柠檬酸盐,并使用Tecnai 12在80kV下进行检查。

图1 制备方法示意图:从ApoE−/-小鼠获得的动脉片段在固定后,用免疫金标记ICAM-1。将组织包埋在Epon中,并制备薄切片。剩余样品用于FIB-SEM检查
为了能够以相关的方式研究动脉粥样硬化斑块,最直接的方法是对完整动脉的横截面进行成像,使用形态学标记在低倍镜下识别斑块区域的位置,然后放大到感兴趣的区域。
使用光学显微镜可以很容易地进行初始成像,然而,到目前为止,制备方法限制了随后在同一区域进行高分辨率分析的成功。因为使用光学显微镜可以对完整小鼠动脉的横截面进行成像(图2a),我们想知道是否也可以使用FIB-SEM对斑块区域进行可视化。
这种显微镜的优点是可以在低放大率的大面积样品,并使用离子束和电子束以高分辨率探索这些感兴趣的区域。为了测试这种方法的可行性,并验证FIB-SEM获得的分辨率是否与传统TEM相当,将ApoE−/−小鼠的动脉嵌入Epon中。
Epon嵌段的表面通过切割超薄(60nm)切片而被平滑。图2(b)显示了使用FIB-SEM获得的动脉低倍扫描电镜显微照片。
事实上,可以对动脉的完整横截面进行成像,并且动脉的斑块和健康区域可以清楚地区分。在穿过血管壁的横截面(图2d)中,在斑块区域观察到脂质负载细胞(黑色箭头)和钙化胆固醇晶体(白色箭头)。弹性薄板在整个血管壁上可见。
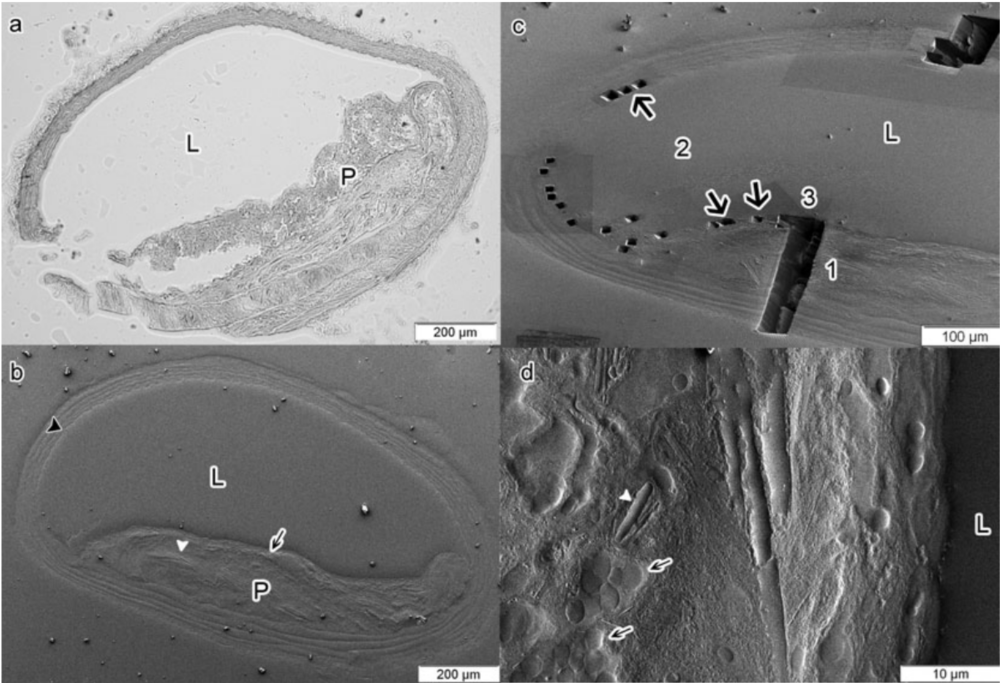
图2 ApoE−/-小鼠动脉粥样硬化组织的FIB-SEM检查
[1] Libby, P. (2002) Inflammation in atherosclerosis. Nature 420, 868–874.
[2] Wilke, K., Wick, K., Keil, F.J., Wittern, K.-J., Wepf, R. & Biel, S.S. (2008) A strategy for correlative microscopy of large skin samples: towards a holistic view of axillary skin complexity. Exp. Dermatol. 17, 73–80.
科学指南针以分析测试为核心,提供材料测试、环境检测、生物服务、模拟计算、科研绘图等多项科研产品,累计服务1800+个高校、科研院所及6000+家企业,获得了60万科研工作者的信赖。始终秉持“全心全意服务科研,助力全球科技创新”的使命,致力于为高校、院所、医院、研发型企业等科研工作者提供专业、快捷、全方位的服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。











 您已经拒绝加入团体
您已经拒绝加入团体

 2025-02-20
2025-02-20
 3899
3899
 0
0










